Przeczytaj
Stan podstawowy i stan wzbudzony
O kolejności obsadzania orbitali atomowych decydują różnice w wartościach energii poszczególnych orbitali. Określa to zasada rozbudowy powłok elektronowych. Zgodnie z nią elektrony zajmują kolejne orbitale w porządku wzrastającej energii, zaczynając zatem od orbitalu o najniższej energii.

n – numer powłoki elektronowej
Z rysunku powyżej wynika, że elektrony, znajdujące się na orbitalu (najbliżej jądra atomowego), mają najniższą energię, a ich siła rośnie w miarę oddalania się od jądra. Ponadto różnice energii orbitali atomowych z kolejnych powłok są, w miarę wzrostu numeru powłoki, coraz mniejsze.
Atom nie wydziela energii, jeśli jego elektrony rozmieszczone są zgodnie z zasadą rozbudowy powłok elektronowych. W takim przypadku atom znajduje się bowiem w stanie podstawowymstanie podstawowym (stan trwały), a wartość jego energii jest najmniejsza. Może jednak zostać wzbudzonywzbudzony po przyjęciu odpowiedniej porcji energii. Dzieje się tak, kiedy energia ta powoduje, że elektron „przeskakuje” na wolny orbital o wyższej energii z tej samej lub innej powłoki elektronowej. Atom znajdujący się w stanie wzbudzonymstanie wzbudzonym posiada wyższą energię niż atom w stanie podstawowym.
Stan podstawowy i wzbudzony atomu fosforu.
W stanie podstawowym atom fosforu posiada konfigurację elektronową:
:
Obsadzenie orbitali przez elektrony w atomie fosforu można przedstawić na diagramie energetycznym.

E – energia orbitali atomowych
Na skutek wzbudzenia atomu fosforu następuje przeskok elektronu, np. z podpowłoki na podpowłokę . W takiej sytuacji, w stanie wzbudzonym atom fosforu posiada konfigurację elektronową:
:
Obsadzenie orbitali przez elektrony w tym stanie można zaprezentować na poniższym diagramie energetycznym.
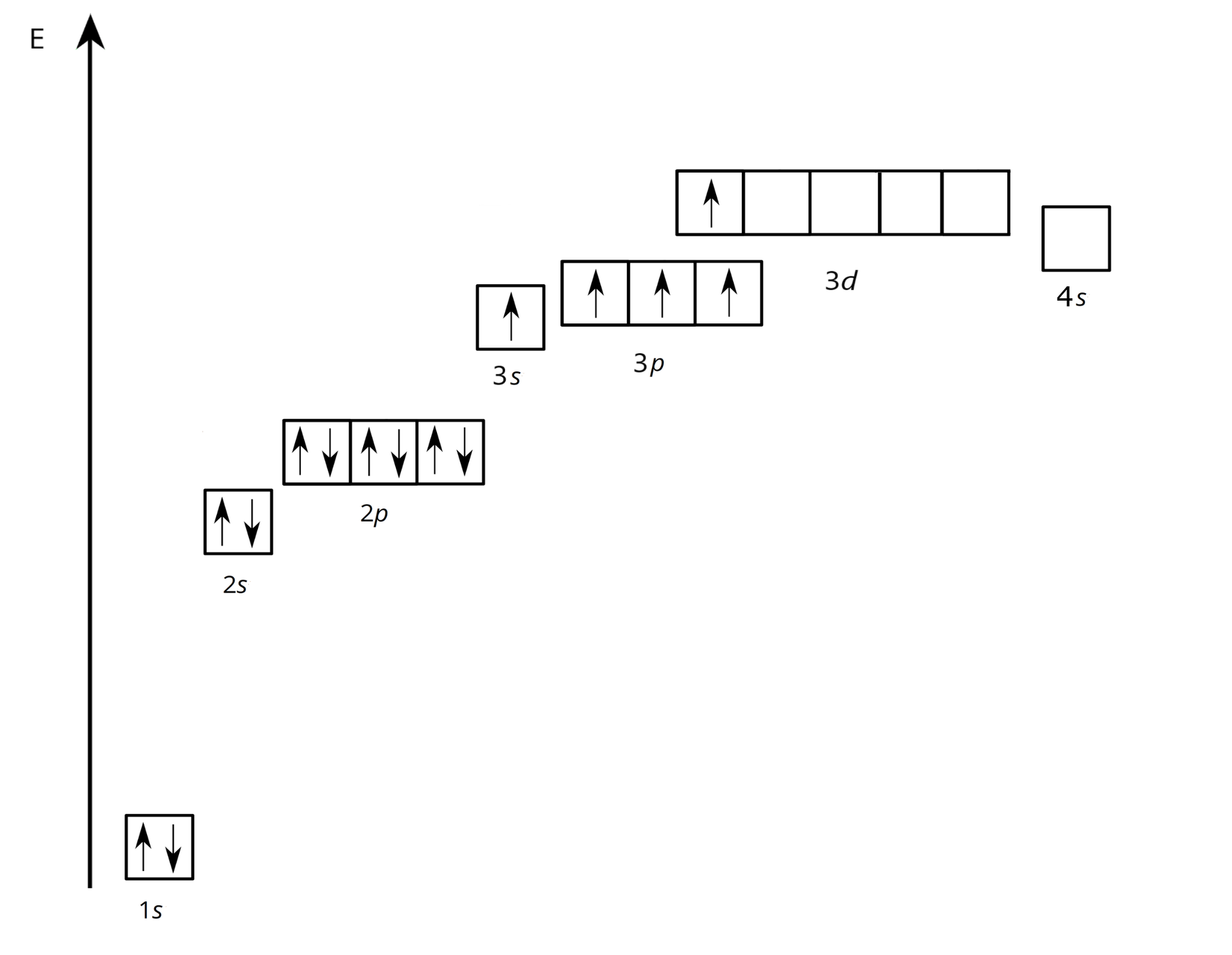
E – energia orbitali atomowych
Na skutek wzbudzenia atomu fosforu, na wyżej energetyczny orbital może zostać przeniesiony również inny elektron, np. z podpowłoki na podpowłokę . W takiej sytuacji w stanie wzbudzonym atom fosforu posiada konfigurację elektronową:
:
Obsadzenie orbitali przez elektrony w tym stanie można zaprezentować na poniższym diagramie energetycznym.

E – energia orbitali atomowych
Na skutek wzbudzenia atomu fosforu na wyżej energetyczny orbital może zostać przeniesiony również inny elektron, np. z podpowłoki na podpowłokę . W takiej sytuacji w stanie wzbudzonym atom fosforu posiada konfigurację elektronową:
:
Obsadzenie orbitali przez elektrony w tym stanie można zaprezentować na poniższym diagramie energetycznym.

E – energia orbitali atomowych
Jak wynika z powyższych ilustracji, przeniesienie elektronu z podpowłoki na podpowłokę wymaga dostarczenia większej ilości energii niż przeniesienie elektronu z podpowłoki na podpowłokę .
Zauważ również, że atom, znajdujący się w stanie podstawowym, może przenieść na wyżej energetyczne orbitale właściwie dowolny elektron, zależnie od tego, jak duża porcja energii zostanie przez ten atom pochłonięta.
Stan podstawowy i wzbudzony atomu siarki.
Konfiguracja elektronowa atomu siarki w stanie podstawowym: :
Poniżej przedstawiono przykładowe stany wzbudzone atomu siarki: :
:
:
Absorpcja a emisja
Przejściu elektronu z jednej powłoki lub podpowłoki na inną towarzyszy emisjaemisja lub absorpcjaabsorpcja energii (rysunek poniżej).

n – numer powłoki elektronowej
E – energia orbitali atomowych
W stanie wzbudzonymstanie wzbudzonym atomu energia elektronów jest wyższa niż w stanie podstawowym. Taki stan cechuje się jednak niewielką trwałością, dlatego elektron samorzutnie oddaje nadmiar energii (najczęściej w postaci światła) i powraca na niższy poziom energetyczny. Następuje wówczas emisjaemisja energii, np. w postaci promieniowania. Najlepszym przykładem tego procesu może być wybuch kolorowych fajerwerków lub emisja światła podczas ogrzewania soli w płomieniu palnika.
Zmiana energii elektronu (odpowiadająca kwantowikwantowi energii) jest równa różnicy energii pomiędzy dwoma stanami stacjonarnymi elektronu: stanem podstawowym a stanem wzbudzonym, co wyraża się wzorem:
gdzie:
, – energie elektronu na dwóch różnych poziomach;
– stała Plancka;
– częstotliwość promieniowania elektromagnetycznego;
– długość fali promieniowania elektromagnetycznego;
– prędkość światła w próżni.
Elektrony i światło
Tym, co wiąże widmo elektromagnetyczne z elektronami, jest energia – w tym przypadku energia kinetyczna elektronu i energia światła. W eksperymencie, który polega na przyłożeniu wysokiego napięcia () do rurki, zawierającej czysty wodór w postaci gazowej pod niskim ciśnieniem, zaobserwowano wzbudzeniewzbudzenie atomów wodoru obecnych w rurce. Zwróciły one pochłoniętą energię w postaci światła, które, wyemitowane w ten sposób, przepuszczono przez pryzmat, co ujawniło z kolei, że składało się z zaledwie kilku określonych częstotliwości, a nie całej gamy kolorów, jak pierwotnie przypuszczano. Widmo promieniowania, uwalnianego przez wzbudzony atom danego pierwiastka w czasie powrotu elektronów na niższe poziomy energetyczne, nazywane jest widmem emisyjnymwidmem emisyjnym tego pierwiastka.
Co mogłoby wyjaśnić fakt, że widmo emisji wodoru składa się zaledwie z kilku linii?
Elektrony pochłaniają energię, przenosząc się tym samym na wyższe poziomy energetyczne, a gdy wracają do stanu o niższej energii, emitują ją w postaci światła o określonej częstotliwości. Elektrony zatem pochłaniają tylko konkretne porcje energii, równe co do wartości różnicy między poziomami energetycznymi, pomiędzy którymi ulegają przejściu. Podobnie, kiedy elektrony wracają do stanu o niższej energii, emitują znów tylko te konkretne porcje energii, uzyskując tylko światło odpowiadające różnicy energii pomiędzy tymi poziomami energetycznymi.
W przypadku widm emisyjnych, kluczowe znaczenie pełni numer powłoki, na którą opadają elektrony w związku z emisją energii. W przypadku opadania na powłoki o niższej energii, emitowane promieniowanie będzie charakteryzować się krótszymi długościami fal, a tym samym większą energią.
Dla atomu wodoru analiza widmowa umożliwiła zaobserwowanie zjawiska przenoszenia elektronów pomiędzy różnymi stanami energetycznymi, co można przedstawić w postaci poniższej grafiki.

W przypadku atomu wodoru, widma emisyjne, które powstają poprzez opadanie elektronów na określone powłoki, określa się mianem serii. Jedną z nich jest seria Balmera – przedstawia ona widmo emisyjne powstające w wyniku opadania elektronów na drugą powłokę. W przypadku serii Balmera, widmo powstaje dzięki temu, że emitowane promieniowanie mieści się w zakresie światła widzialnego, więc jest łatwo obserwowalne dla badaczy. Innymi przykładami serii, obserwowanych dla wodoru, są m. in. seria Lymana (opadanie elektronów na pierwszą powłokę i emisja promieniowania w zakresie nadfioletu) czy seria Paschena (opadanie elektronów na trzecią powłokę i emisja promieniowania w zakresie podczerwieni).
Zorza polarna to fantastyczny pokaz świetlny, widoczny tylko na wysokości północnych szerokości geograficznych. Dawniej uważano, że przyczyną tego zjawiska jest odbicie światła od polarnych pól lodowych. Okazało się, że przyczyną zórz polarnych jest wiatr słoneczny, czyli strumień naładowanych cząstek (protonów i elektronów), które, uwięzione w polu magnetycznym Ziemi, przenikają do jonosfery. Tam cząstki zderzają się z cząsteczkami tlenu i azotu, po czym przekazują im energię. Ta z kolei powoduje przeskok elektronów w atomach na wyższy poziom energetyczny. Powrót elektronów do niższego poziomu skutkuje uwolnieniem pochłoniętej energii. Kiedy częstotliwości promieniowania leżą w zakresie światła widzialnego, mogą być postrzegane jako zorza polarna. Tlen atomowy emituje biało‑zielone światło, natomiast azot cząsteczkowy wydziela światło koloru czerwonego.
Słownik
stan, w którym elektrony rozmieszczone są w taki sposób, aby atom posiadał najmniejszą energię
każdy stan elektronu o energii wyższej od energii stanu podstawowego; jest wynikiem przejścia elektronu (po pobraniu energii) z podpowłoki o niższej energii na podpowłokę o energii wyższej; jeśli atom znajduje się w stanie wzbudzonym, dopisywany jest przy nim symbol gwiazdki
proces, w czasie którego na skutek pochłonięcia energii następuje przeniesienie elektronu na wyższe poziomy energetyczne
(łac. absorptio „wchłanianie”) pochłanianie (całkowite lub częściowe) energii promieniowania elektromagnetycznego, fal sprężystych lub promieniowania korpuskularnego (elektronów, neutronów, cząstek alfa i innych) przez ośrodek, w którym rozchodzi się to promieniowanie
(łac. emissio „wypuszczanie’”) wysyłanie przez dany układ promieniowania elektromagnetycznego; jest wynikiem przejścia (np. atomu, cząsteczki) ze stanu wzbudzonego do stanu o niższej energii
(łac. quantum „ile”) najmniejsza porcja, o jaką może się zmienić dana wielkość fizyczna określonego układu fizycznego
widmo liniowe powstające w wyniku przejścia cząstki ze stanu wzbudzonego do stanu o niższej energii, czemu towarzyszy emisja energii
Bibliografia
Atkins P., Jones J., Chemia ogólna. Cząsteczki, materia, reakcje, Warszawa 2004.
Bielański A., Podstawy Chemii nieorganicznej, t. 1‑2, Warszawa 2010.
Czerwiński A., Czerwińska A., Jeziorna M., Kańska M., Chemia 3. Podręcznik dla liceum ogólnokształcącego, liceum profilowanego, technikum, Warszawa 2004.
Encyklopedia PWN
Hassa R., Mrzigod A., Mrzigod J., Sułkowski W., Chemia 1. Podręcznik i zbiór zadań w jednym, Warszawa 2003.
Litwin M., Styka‑Wlazło Sz., Szymońska J., To jest chemia 1, Warszawa 2013.
Pazdro K., Zbiór zadań z chemii dla szkół ponadgimnazjalnych, Warszawa 2003.





