Przeczytaj
Rys historyczny odkrycia tlenu
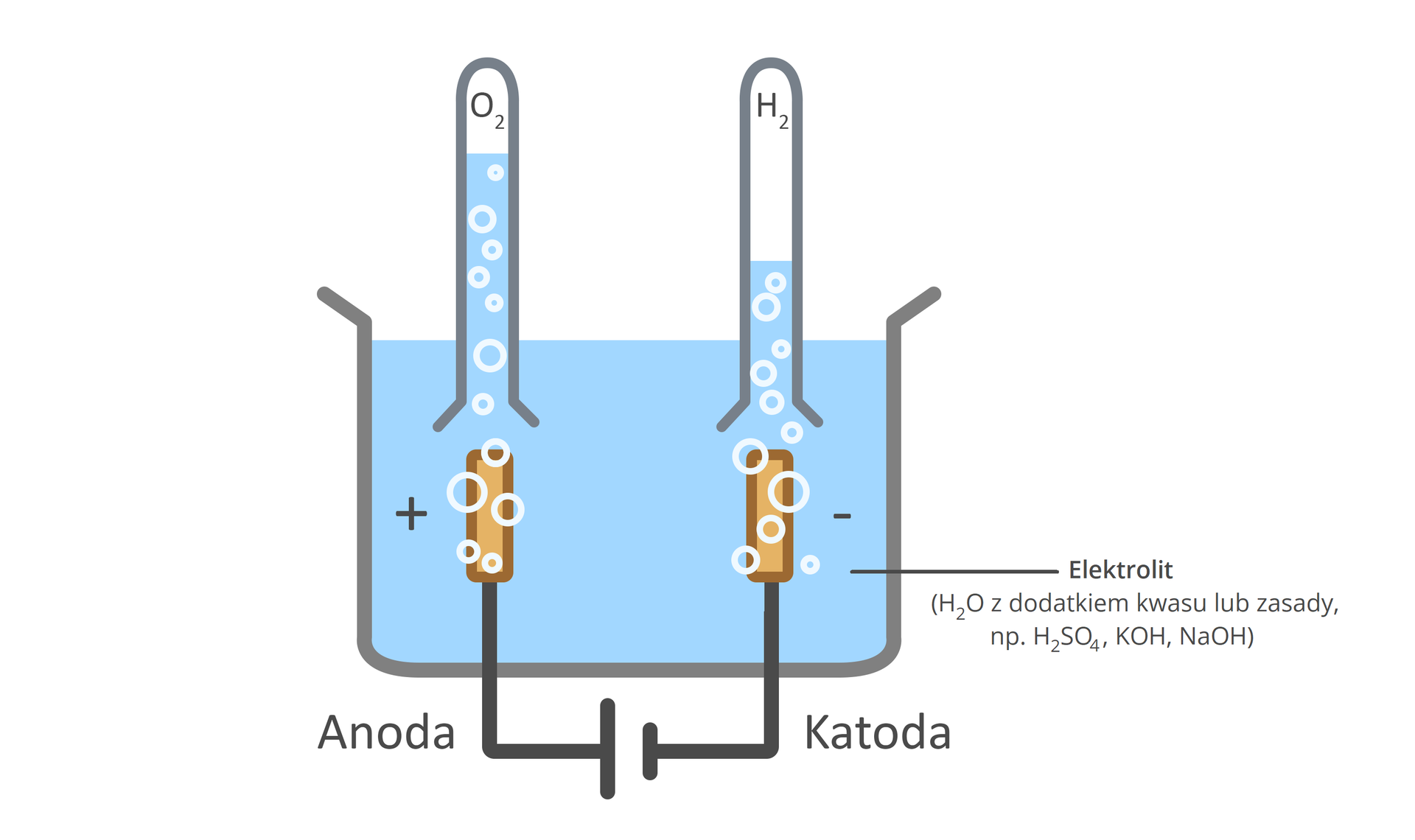
Elektrolityczny rozkład wody
Tlen można otrzymać również w wyniku elektrolizyelektrolizy wody.
Równanie reakcji katodowej:
Równanie reakcji anodowej:
Po zsumowaniu:
W związku z tym, że jony i nie mogą być razem po jednej stronie równania, zobojętniają się one tworząc cząsteczki wody.
Równanie reakcji:
Elektrolityczny rozkład wody
Elektroliza wody to proces rozkładu cząsteczki wody pod wpływem prądu elektrycznego, prowadzący do otrzymania tlenu i wodoru. Proces ten prowadzony jest przez zanurzenie elektrod w roztworze elektrolitu, czyli substancji przewodzącej prąd elektryczny. Elektrolitem mogą być stopione lub rozpuszczone związki, które ulegają dysocjacji elektrolitycznej na jony. Ponieważ nie przewodzi prądu, podczas elektrolizy wykorzystuje się wodne roztwory kwasów lub zasad, np. , lub .
Katalityczny rozkład nadtlenku wodoru
Poniższe doświadczenie należy wykonywać pod sprawnym wyciągiem. Wykonując doświadczenie należy zachować szczególne środki ostrożności i zapoznać się z kartami charakterystyki używanych substancji. Ponadto wykonujący ćwiczenie powinien być zaopatrzony w fartuch, rękawiczki, okulary ochronne lub przyłbicę. Po zakończeniu pracy suche pozostałości należy odpowiednio zutylizować lub przechowywać w przeznaczonych do tego pojemnikach.
Schemat doświadczenia:

Słownik
sól, w której strukturze znajdują się aniony azotanowe() i kationy odpowiedniego metalu lub kationy amonu. Saletry znajdują praktyczne zastosowania takie jak np. nawozy czy do peklowania żywności
reakcja, w której dochodzi do przeniesienia jednego lub więcej elektronów od atomu, jonu lub cząsteczki donora (czyli reduktora) do akceptora (czyli utleniacza)
zmiana składu substancji chemicznej pod wpływem przyłożonego zewnętrznego napięcia elektrycznego
Bibliografia
Atkins P., Jones, L., Laverman L., (2016).Chemical Principles: The Quest for Insight, 7th edition, 2020.
Bielański A., Podstawy chemii nieorganicznej, t. 2, Warszawa 2012.
Pigoń K., Ruziewicz Z., Chemia fizyczna, cz. 1, Warszawa 1986.