Przeczytaj
Tlenki
To związki tlenu z innymi pierwiastkami, w których atomy tlenu występują na stopniu utlenieniastopniu utlenienia. Wzór ogólny tlenków prostych ma postać:
gdzie:
– oznacza symbol dowolnego pierwiastka chemicznego;
, – odpowiednie indeksy stechiometryczne.
Ogólny wzór chemicznywzór chemiczny tlenków oraz ich wybrane przykłady przedstawiono poniżej.

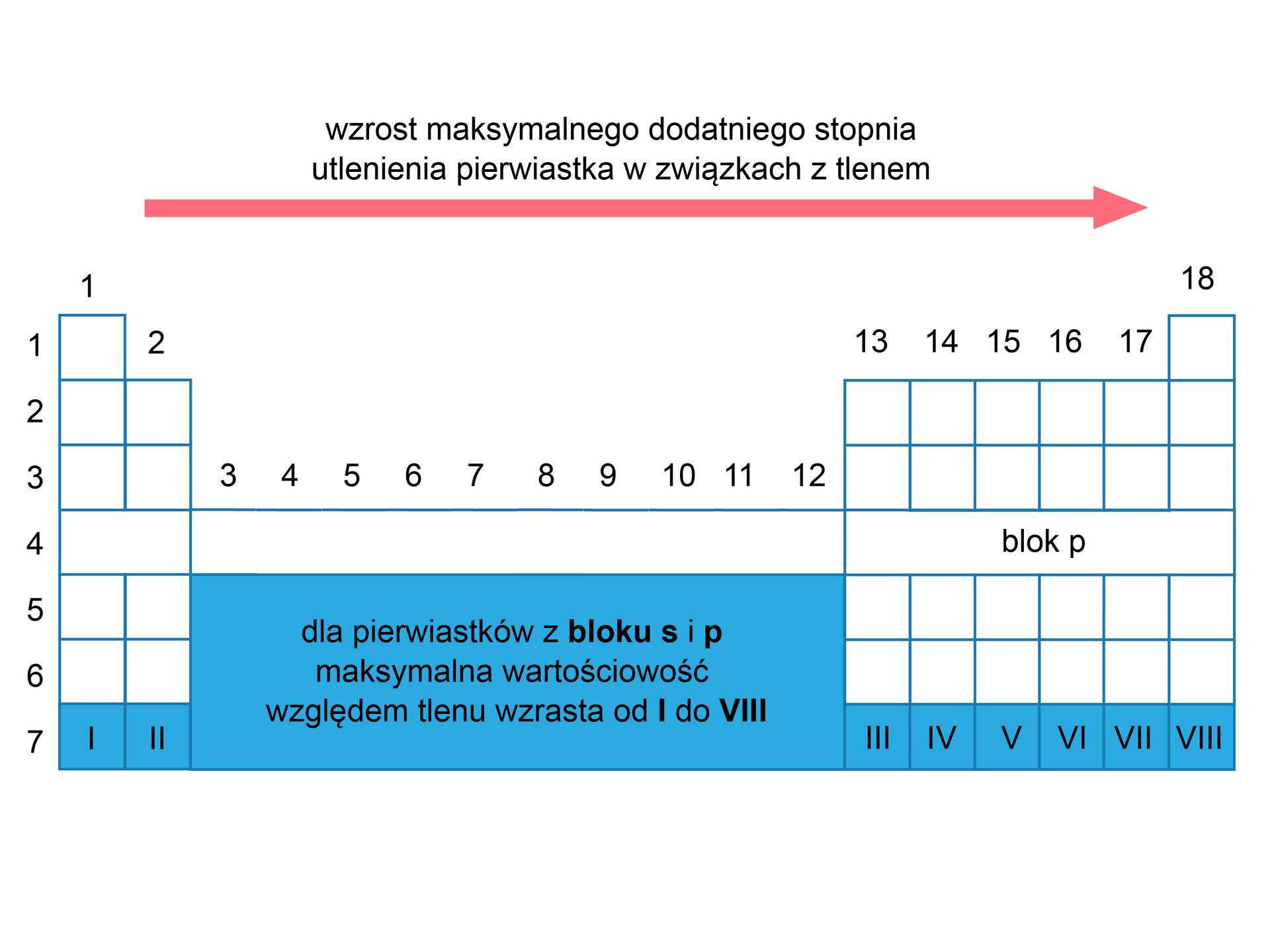
Maksymalny stopień utlenienia
Zmiany maksymalnego stopnia utlenieniastopnia utlenienia pierwiastków w związkach z tlenem przedstawia poniższy rysunek.
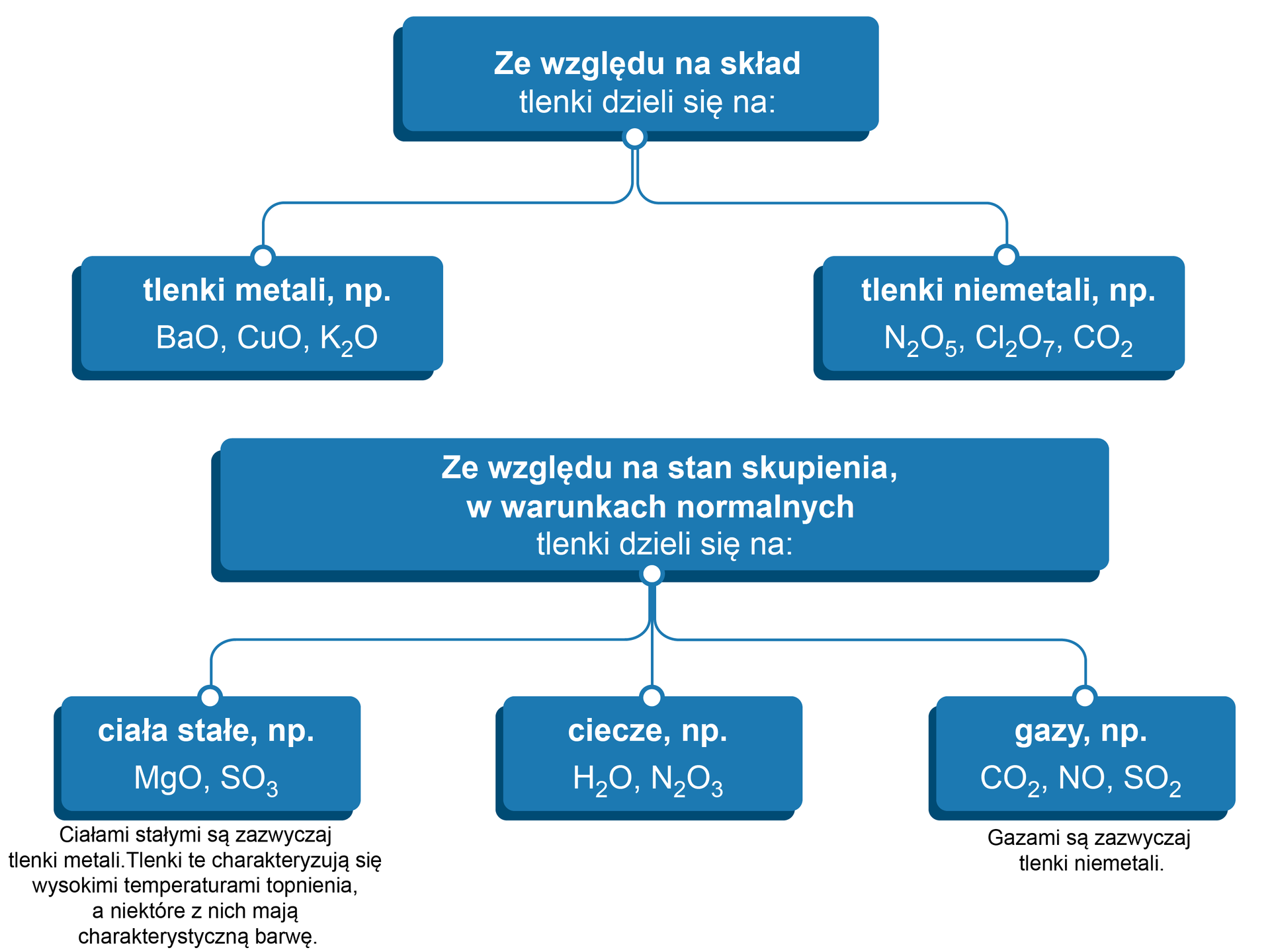
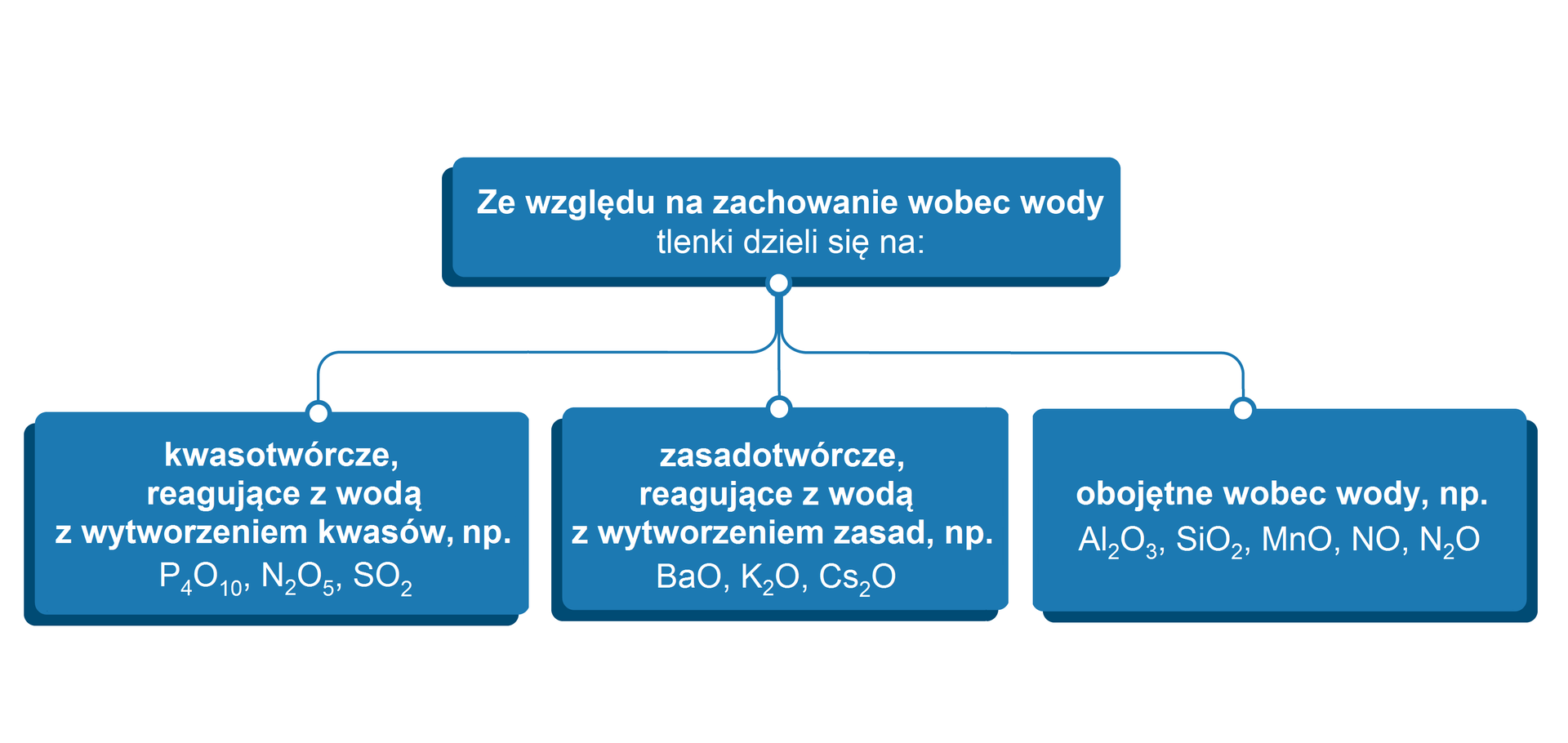
Sposoby klasyfikacji tlenków
Istnieją różnorodne systemy klasyfikacji tlenków. Poniżej przedstawiono wybrane z nich.
Nazewnictwo tlenków
W systemie Stocka nazwy tlenków są dwuczłonowe, a podaje się je poprzez połączenie ze sobą słowa „tlenek” z nazwą pierwiastka chemicznego w dopełniaczu, przykładowo:
– tlenek sodu.
Jeśli dany pierwiastek chemiczny tworzy więcej niż jeden tlenek, po dwuczłonowej nazwie w nawiasie należy podać stopień utlenienia (w postaci cyfry rzymskiej) pierwiastka w danym tlenku (bez spacji między drugim członem nazwy a nawiasem z podanym stopniem utlenienia). Przykładowo:
– tlenek żelaza() oraz – tlenek żelaza().
Nazwa tlenku (wg Systemu Stocka) | Wzór tlenku | Stopień utlenienia atomów pierwiastka w tlenku |
|---|---|---|
tlenek sodu | ||
tlenek litu | ||
tlenek wapnia | ||
tlenek magnezu | ||
tlenek skandu() | ||
tlenek tytanu() | ||
tlenek wanadu() | ||
tlenek chromu() | ||
tlenek manganu() | ||
tlenek żelaza() | ||
tlenek kobaltu() | ||
tlenek niklu() | ||
tlenek miedzi() | ||
tlenek cynku | ||
tlenek glinu | ||
tlenek węgla() | ||
tlenek węgla() | ||
tlenek ołowiu() | ||
tlenek ołowiu() | ||
tlenek azotu() | ||
tlenek azotu() | ||
tlenek azotu() | ||
tlenek siarki() | ||
tlenek siarki() | ||
tlenek chloru() | ||
tlenek chloru() | ||
tlenek chloru() |
Właściwości chemiczne tlenków
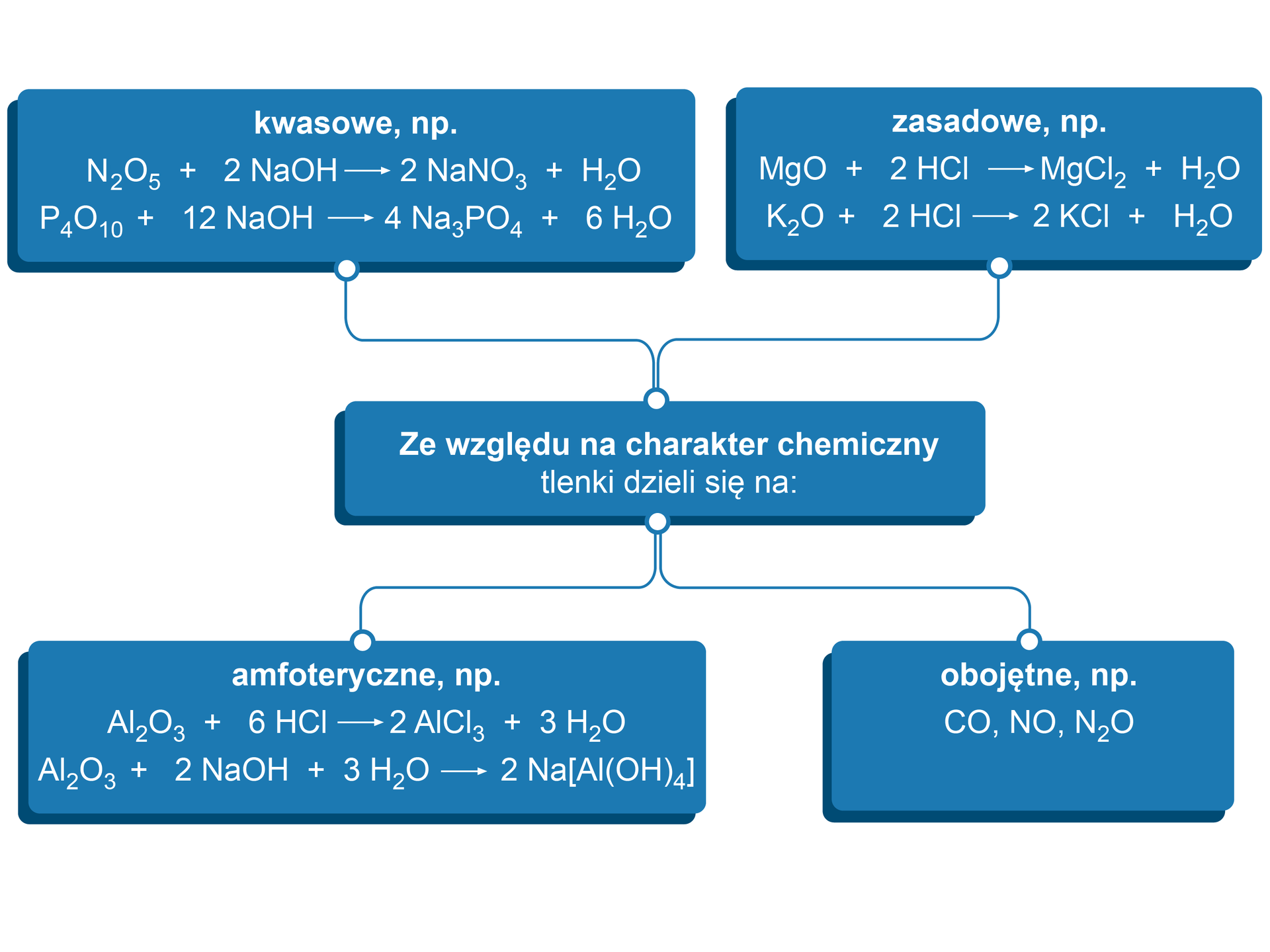
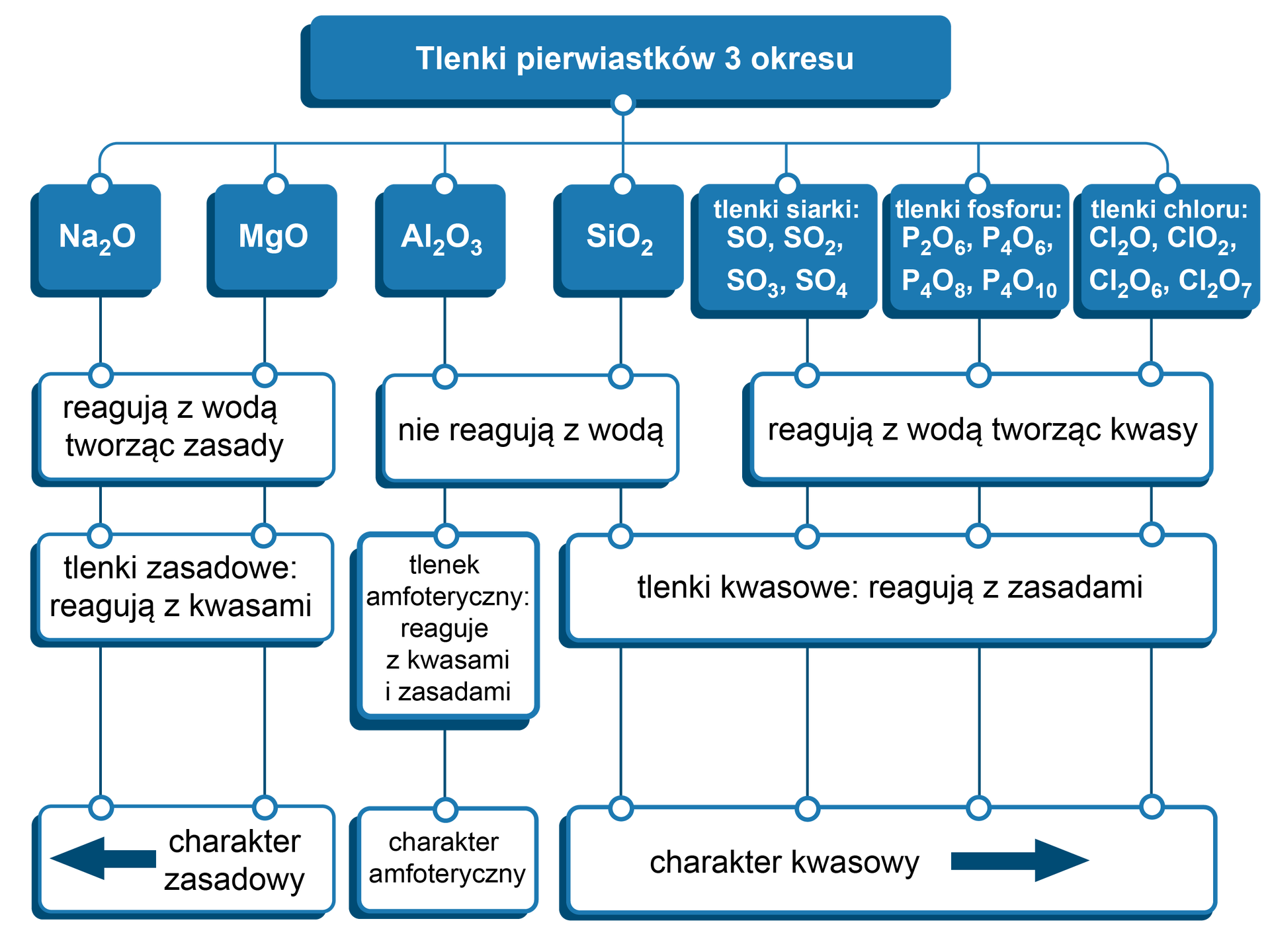
Właściwości tlenków w głównej mierze zależą od położenia pierwiastka tworzącego dany tlenek w układzie okresowymukładzie okresowym. Ogólnie można wywnioskować, że tlenki niemetali są w dużej mierze tlenkami wykazującymi charakter kwasowy, natomiast tlenki metalimetali wykazują zazwyczaj charakter zasadowy. Mimo to tej tendencji nie powinno się traktować w sposób bezwzględny.
Tlenki kwasowe reagują z tlenkami zasadowymi, tworząc odpowiednie sole kwasów tlenowych, np.:
;
.
, Tlenki zasadowe (reagujące z kwasami, a niereagujące z zasadami) Do tlenków zasadowych zaliczamy wszystkie tlenki zasadotwórcze (tlenki metali grup I i II z wyjątkiem BeO) oraz m.in. tlenek manganu(II) i tlenek chromu(II).
Tlenki zasadowe reagują z tlenkami kwasowymi, tworząc odpowiednie sole kwasów tlenowych, np.:
, Tlenki amfoteryczne (reagujące z mocnymi kwasami i mocnymi zasadami) np.: , , , , , ,
tetrahydroksoglinian sodu
Pisząc równanie reakcji tlenku amfoterycznego z mocną zasadą, wśród substratów reakcji należy uwzględnić również wodę, np.:
;
tetrahydroksoberylan sodu.
Tlenki amfoteryczne nie reagują z wodą, np.:
→ reakcja nie zachodzi;
→ reakcja nie zachodzi.
Warto pamiętać, że podczas reakcji tlenku amfoterycznego z mocną zasadą tworzą się związki koordynacyjne (tzw. hydroksokompleksy)., Tlenki obojętne (nie reagują z wodą ani z kwasami i zasadami) , , , .
Zmiana charakteru chemicznego wybranych tlenków na tle układu okresowego
Zmiana charakteru tlenków zależna jest od położenia pierwiastka tworzącego dany tlenek w układzie okresowym. Tlenki metali reagują z kwasami – nazywamy je tlenkami zasadowymi. Te, które reagują z zasadami, nazywamy tlenkami kwasowymi – są to głównie tlenki niemetali. Istnieją również tlenki amfoteryczneamfoteryczne, reagują one zarówno z kwasami, jak i zasadami.
Słownik
(gr. amphóteros „dwustronny”) właściwość niektórych indywiduów chemicznych, polegająca na zdolności do reagowania zarówno z kwasami, jak i zasadami
(gr. métallon „kopalnia, kruszec”) substancje odznaczające się dobrym przewodnictwem elektrycznym i cieplnym, charakterystycznym połyskiem, dużą wytrzymałością mechaniczną oraz plastycznością
umowny zapis jakościowego i ilościowego składu lub budowy cząsteczek pierwiastków i związków chemicznych za pomocą symboli chemicznych
ładunek jonu, w jaki przekształciłby się atom danego pierwiastka, gdyby wszystkie tworzone przez niego wiązania miały charakter jonowy
sposób klasyfikacji pierwiastków chemicznych w tabeli, powstałej w wyniku ułożenia pierwiastków wg wzrastającej liczby atomowej oraz wg ich właściwości chemicznych
Bibliografia
M. Krzeczkowska, J. Loch, A. Mizera, Repetytorium chemia. Liceum – poziom podstawowy i rozszerzony, Warszawa – Bielsko‑Biała 2010.