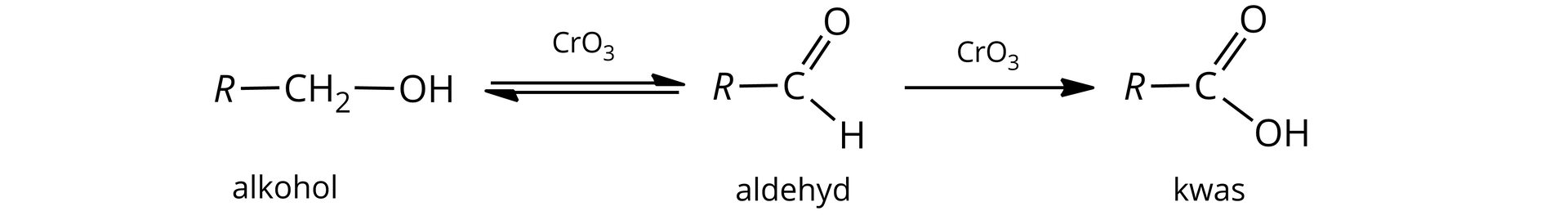
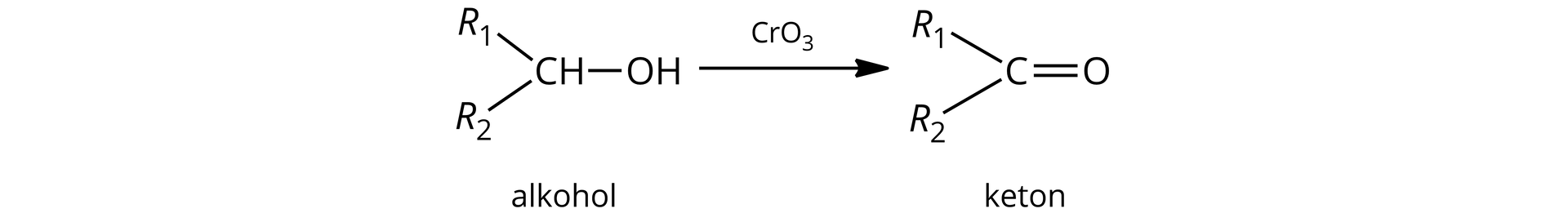
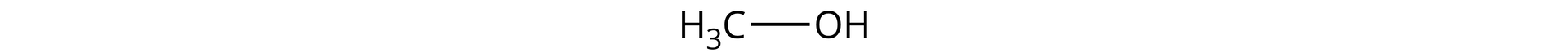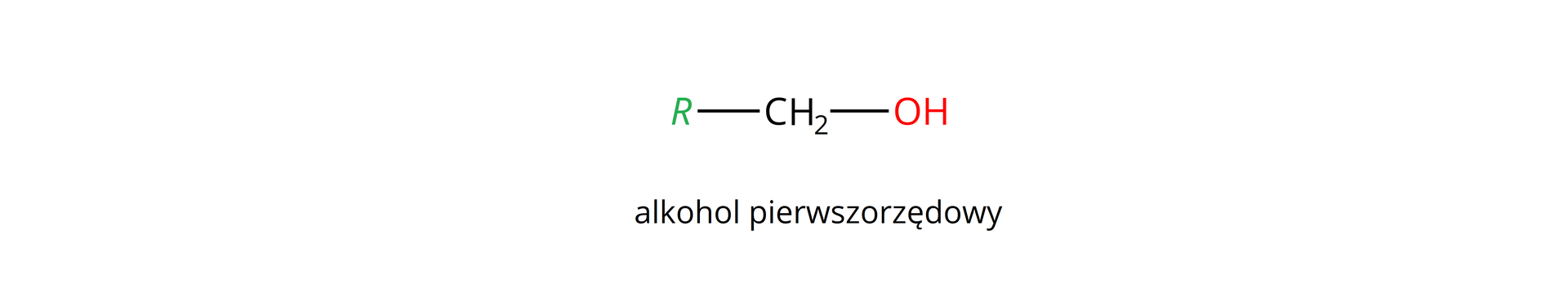Przeczytaj
Alkohole
Alkohole to klasa związków organicznych, w cząsteczkach których grupy hydroksylowegrupy hydroksylowe (przez atom tlenu) są przyłączone bezpośrednio do atomów węgla o hybrydyzacji .
W związku z powyższym, alkohole monohydroksylowe możemy zdefiniować jako pochodne węglowodorów, w których atom wodoru został zastąpiony jedną grupą funkcyjną- hydroksylową. Ogólny wzór nasyconych alkoholi monohydroksylowych można zatem zapisać jako:
– grupa alkilowa
Na pierwszy rzut oka wzór ten może kojarzyć się z zupełnie inną klasą związków nieorganicznych – z wodorotlenkami (np. , ), jednak w przeciwieństwie do tych jonowych związków, alkohole posiadają w cząsteczkach wyłącznie wiązania kowalencyjne i kowalencyjne spolaryzowane.
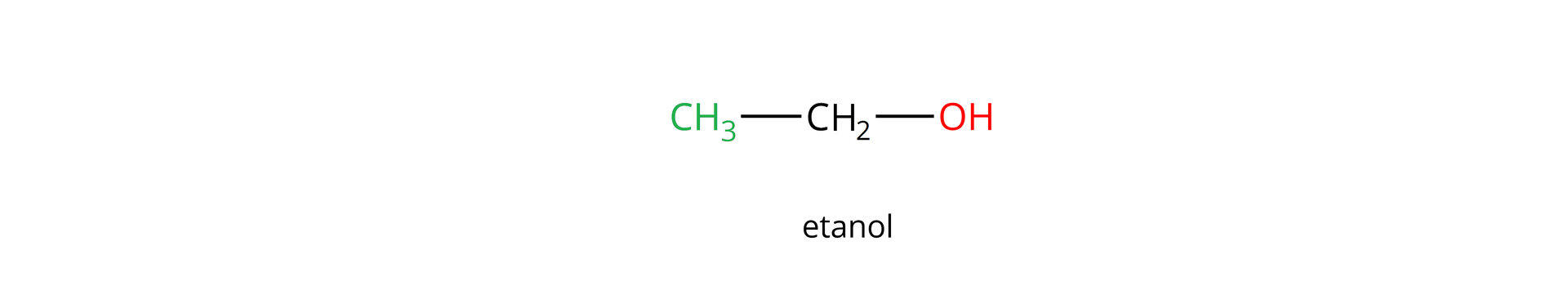
Alkohole stanowią klasę bardzo powszechnych związków występujących w przyrodzie, które mają szerokie zastosowanie w wielu gałęziach przemysłu, farmacji i medycynie. Jednym z przykładów alkoholi jest etanol, który wykorzystywany jest jako środek dezynfekujący, dodatek do paliw, rozpuszczalnik przemysłowy czy jako produkt konsumpcyjny pod różnymi postaciami.
W jaki sposób klasyfikuje się alkohole pod względem rzędowości?
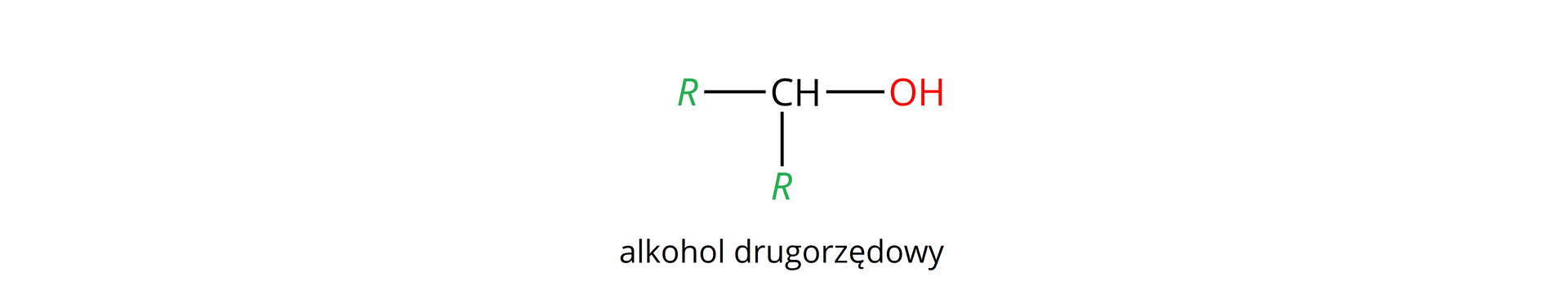
Istnieją różne przykłady alkoholi. W tym rozdziale skupimy się wyłącznie na nasyconych alkoholach monohydroksylowych, które w zależności od położenia grupy hydroksylowej w cząsteczce, a tym samym od liczby grup organicznych przyłączonych do atomu węgla z tą grupą (), mają różną rzędowość.
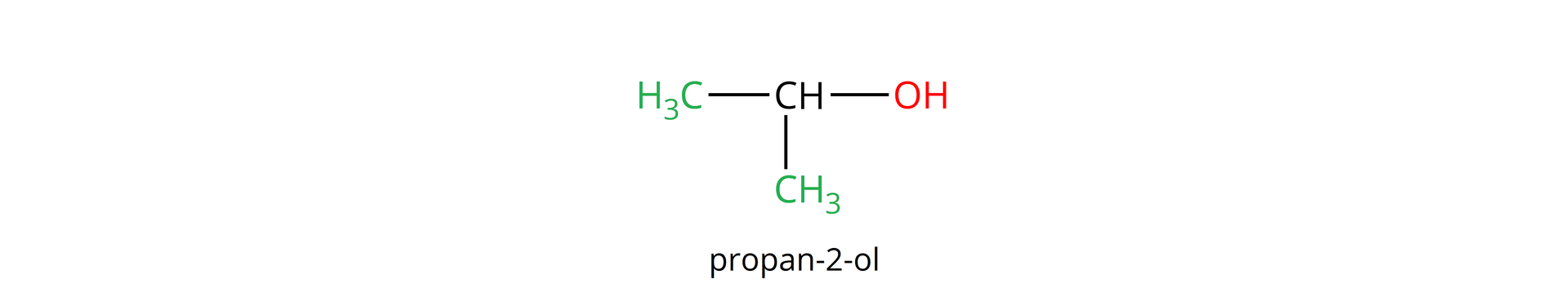
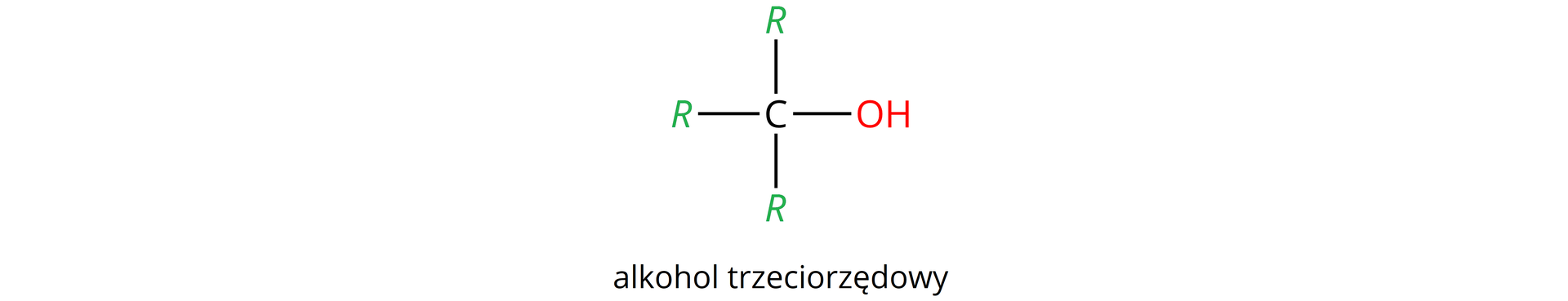
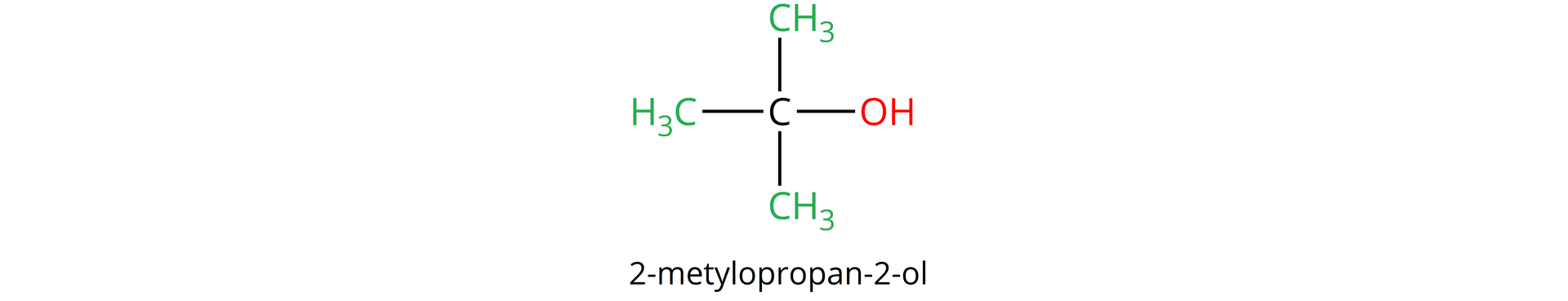
Rzędowość alkoholi określa z iloma atomami węgla, w cząsteczce analizowanego alkoholu, połączony jest atom węgla z przyłączoną grupą hydroksylową, np.:
Określ rzędowość –metylopentan––olu.
W celu określenia rzędowości należy narysować strukturę podanego alkoholu. Najdłuższy łańcuch tego alkoholu zawiera ugrupowań węglowych:
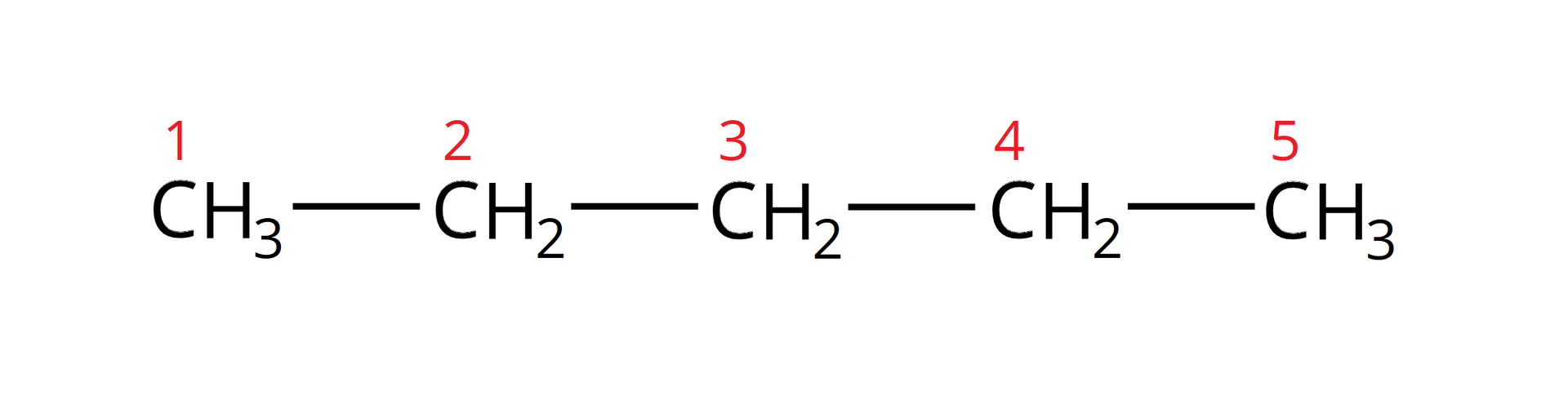
Do drugiego z kolei węgla przyłączona jest grupa metylowa i grupa hydroksylowa:
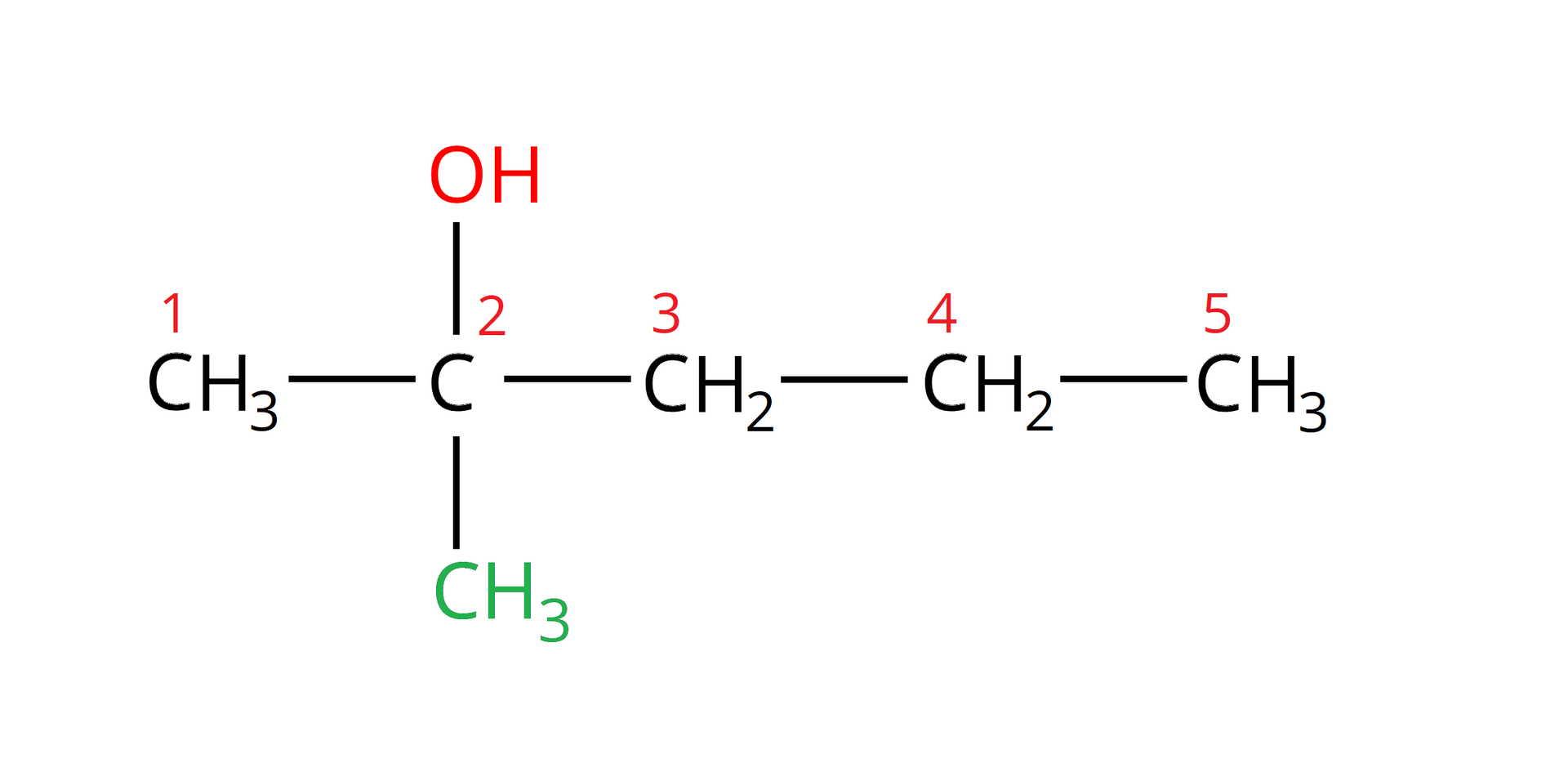
Na podstawie narysowanej struktury można zauważyć, że grupa hydroksylowa przyłączona jest do atomu węgla, który z kolei przyłączony jest do innych atomów węgla (do żadnego atomu wodoru). Zatem jest to alkohol –rzędowy.
Rzędowość alkoholi a ich właściwości
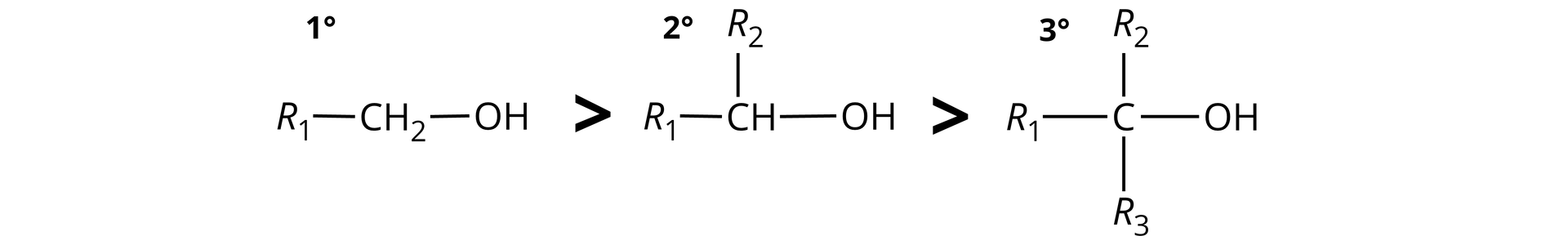
Kwasowość alkoholi zależy od ich rzędowości. Im większa rzędowość alkoholi, tym mniejsza ich kwasowość (tym mniejsza jest ich stała kwasowości ). Zależność ta jest związana z silniejszym oddziaływaniem chmury elektronowej na wiązania: tlen‑wodór oraz węgiel‑tlen w alkoholach o wyższej rzędowości.
Wprowadzenie do cząsteczki alkoholu atomów lub grup elektronoakceptorowych lub elektronoujemnych, np. atomu fluorowca, powoduje wzrost kwasowości alkoholu. Tłumaczone jest to indukcyjnym oddziaływaniem wiązania węgiel‑fluorowiec na wiązania: węgiel–tlen oraz tlen–wodór.
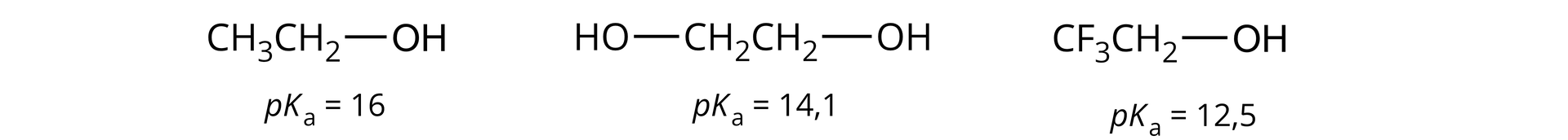
Rzędowość alkoholi ma wpływ na ich reaktywność w różnych reakcjach organicznych.
Słownik
jednowartościowa grupa atomów składająca się z atomu tlenu i atomu wodoru
atom, jon lub cząsteczka, która w reakcji oksydacyjno‑redukcyjnej jest akceptorem elektronu (elektronów)
usunięcie ze związku chemicznego atomów wodoru i tlenu lub usunięcie cząsteczek wody ze związków uwodnionych
Bibliografia
Dudek‑Różycki K., Płotek M., Wichur T., Węglowodory. Repetytorium i zadania, Kraków 2020.
Dudek‑Różycki K., Płotek M., Wichur T., Kompendium terminologii oraz nazewnictwa związków organicznych. Poradnik dla nauczycieli i uczniów, Kraków 2020.
McMurry J., Chemia organiczna, t. 1–5, Warszawa 2003.
Hejwowska S., Marcinkowski R., Chemia organiczna, Gdynia 2005.