Przeczytaj
Właściwości fizyczne, takie jak np. stan skupienia w temperaturze pokojowej oraz właściwości chemiczne (rozpuszczalność w wodzie, charakter kwasowo–zasadowy), wynikają z budowy danego związku oraz z charakteru występującego w nim wiązania.
Na podstawie temperatury wrzenia można wysnuć wnioski dotyczące rodzaju wiązania oraz oddziaływań międzycząsteczkowych. Niskie temperatury wrzenia cechują substancje zbudowane z cząsteczek o charakterze niepolarnym, wówczas jedynym rodzajem oddziaływań, które zachodzą między cząsteczkami, są wyłącznie słabe oddziaływania van der Waalsaoddziaływania van der Waalsa. Silniejsze oddziaływania obserwuje się między dipolami, a z kolei obecność atomu wodoru, związanego z silnie elektroujemnym atomem fluoru, tlenu lub azotu, warunkuje możliwość tworzenia wiązań wodorowychwiązań wodorowych. Najwyższe temperatury wrzenia są obserwowane dla substancji o budowie jonowej, ponieważ wiązanie jonowewiązanie jonowe ma charakter kolektywny, tj. obejmuje wszystkie jony, które wchodzą w skład kryształu.
Budowa związku chemicznego warunkuje także właściwości chemiczne, takie jak charakter kwasowy lub zasadowy.
Właściwości fizyczne i chemiczne wodorków
Wodorki niemetali mają następujące właściwości:

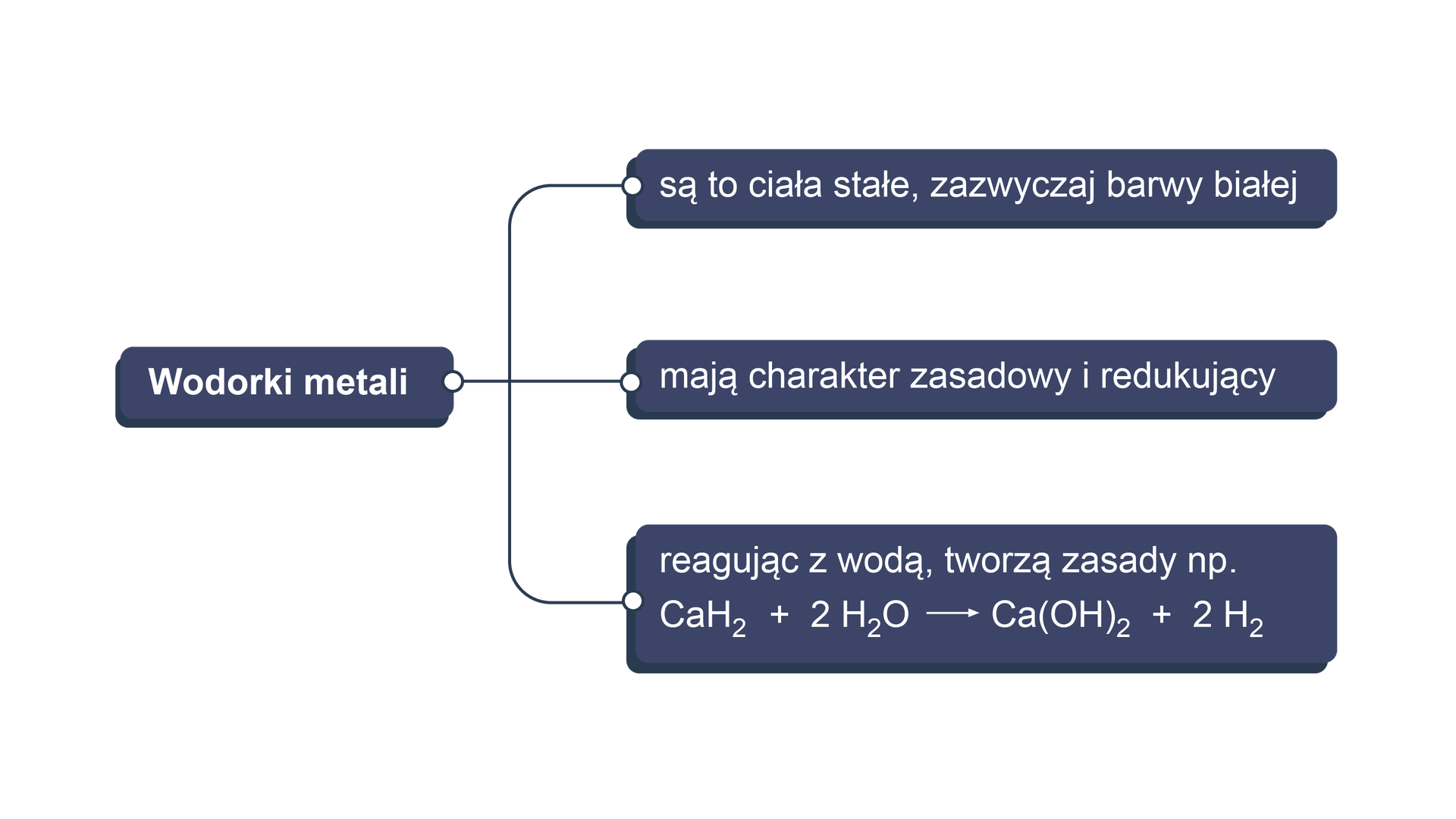
Wodorki metali mają odmienne właściwości:
Słownik
wiązanie chemiczne, polegające na uwspólnieniu pary elektronowej pomiędzy dwoma związanymi atomami; atomy połączone tym wiązaniem cechują się wysoką elektroujemnością i niewielką różnicą elektroujemności; w przypadku większej różnicy elektroujemności niż , obserwuje się polaryzację wiązania ( wiązanie kowalencyjne spolaryzowanewiązanie kowalencyjne spolaryzowane)
przypadek wiązania kowalencyjnego pomiędzy dwoma atomami, wyraźnie różniącymi się elektroujemnością (więcej niż ); jako górną granicę różnicy elektroujemności przyjmuje się (powyżej tej wartości wiązanie jonowewiązanie jonowe), należy jednak zwrócić uwagę na charakter związku – substancja, która posiada wiązania kowalencyjne spolaryzowane, tworzy cząsteczki
oddziaływanie o charakterze elektrostatycznym pomiędzy jonami: przyciąganie różnoimiennych jonów i odpychanie jednoimiennych; substancja jonowa występuje w postaci kryształu jonowego, w którym każdy jon oddziałuje z pozostałymi w krysztale – jest to więc wiązanie niekierunkowe
oddziaływania pomiędzy cząsteczkami warunkujące niektóre właściwości fizyczne, jak np. temperatura wrzenia; najsilniejsze oddziaływania międzycząsteczkowe (około ) są słabsze od najsłabszych wiązań chemicznych (kilkaset ); ze względu na energię oddziaływania, można je uszeregować: wiązania wodorowe (kilkadziesiąt ), oddziaływania van der Waalsa (poniżej kilku )
oddziaływania o charakterze niekowalencyjnym pomiędzy atomem wodoru, który jest związany bezpośrednio z silnie elektroujemnym atomem o małym promieniu atomowym (, , ); obecność wiązań wodorowych pomiędzy cząsteczkami zazwyczaj znacznie podwyższa temperaturę wrzenia
grupa oddziaływań o charakterze elektrostatycznym, różniących się energią; są obecne pomiędzy wszystkimi cząsteczkami/atomami, natomiast ze względu na swoją nieznaczną energię, uwzględniane są jedynie w przypadku braku innych, silniejszych oddziaływań; najsilniejsze oddziaływania van der Waalsa występują pomiędzy dipolami trwałymi; energia tych oddziaływań maleje wraz z polarnością cząsteczki oraz wiązań; najsłabsze wiązania van der Waalsa występują pomiędzy atomami helowców i wynikają z oddziaływania pomiędzy chwilowymi dipolami, utworzonymi na skutek chwilowych zaburzeń rozkładu gęstości elektronowej wokół atomów gazów szlachetnych
Bibliografia
Bielański A., Podstawy chemii nieorganicznej, Warszawa .