Przeczytaj
Utlenianie i utleniacze
UtlenianieUtlenianie to reakcja, w której jony lub atomy oddają elektrony innym atomom, w wyniku czego dochodzi do podwyższenia stopnia utlenieniastopnia utlenienia atomu oddającego elektrony. UtleniaczemUtleniaczem nazywamy substancję, której atomy obniżają swój stopień utlenienia. Do silnych utleniaczy (a więc substancji wykazujących silne właściwości utleniające) zaliczają się między innymi następujące sole: manganian() potasu oraz dichromian() potasu .
Badanie właściwości utleniających
manganianu() potasu
Właściwości utleniające manganianu() potasu
Schemat doświadczenia:
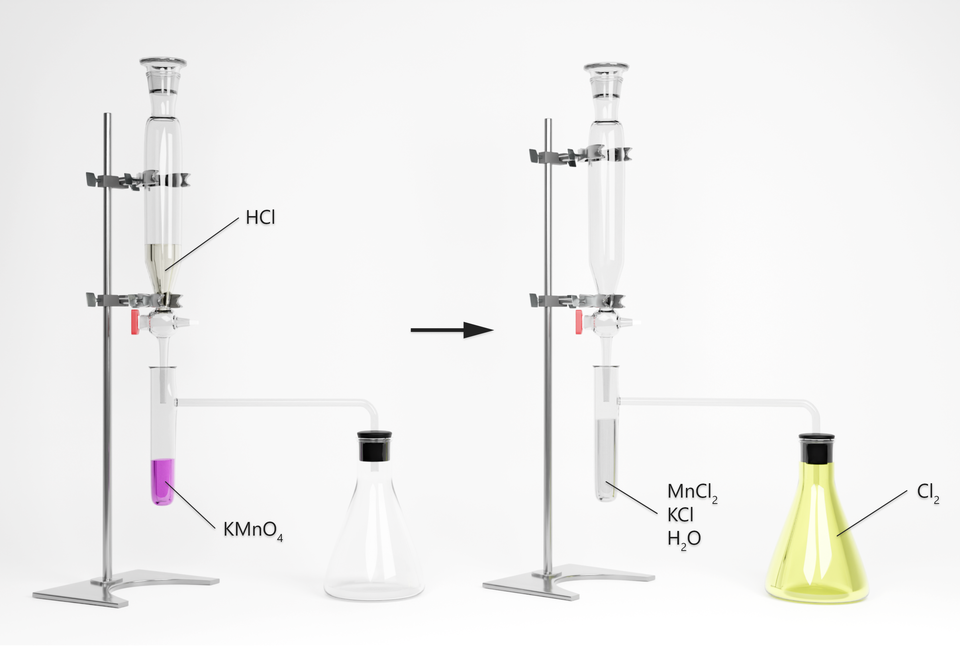
Równania reakcji chemicznych:
Analiza doświadczenia: Właściwości utleniające manganianu() potasu
Sprzęt i odczynniki:
probówka z korkiem i rurką odprowadzającą;
kolba stożkowa z korkiem;
wkraplacz;
stężony wodny roztwór manganianu() potasu;
stężony kwas chlorowodorowy .
Instrukcja wykonania:
W probówce umieszczono centymetry sześcienne stężonego wodnego roztworu manganianu() potasu.
Do wkraplacza wprowadzono centymetrów sześcienne stężonego kwasu chlorowodorowego.
Do probówki, za pomocą wkraplacza, stopniowo wkraplono kwas chlorowodorowy.
Obserwowano zmiany.
Uwaga! W trakcie przeprowadzania doświadczenia zachowano ostrożność i pamiętano o okularach, a całość działań prowadzano pod wyciągiem. Należało też unikać wdychania par chloru.
Obserwacje:
W probówce nastąpiło odbarwienie fioletowego roztworu (zmiana barwy z fioletowej na bezbarwną). W probówce wydzielił się żółtozielony gaz, który został zebrany w kolbie stożkowej.
Wnioski:
Manganian() potasu utlenił jony chlorkowe do wolnego chloru. W środowisku kwasowym manganian()potasu uległ redukcji z wytworzeniem jonów manganu().
Równania reakcji chemicznych:
Manganian() potasu (dokładniej atom manganu, występujący w tym związku na stopniu utlenienia) wykazuje właściwości utleniające we wszystkich środowiskach: kwasowym, obojętnym i zasadowym. Im środowisko jest bardziej kwasowe, tym silniejsze właściwości utleniające . Należy zwrócić uwagę, że sam, w zależności od środowiska, redukuje się do różnych związków lub jonów:
Badanie właściwości utleniających dichromianu() potasu
Właściwości utleniające dichromianu() potasu
Schemat doświadczenia:

Równania reakcji chemicznych:
Analiza doświadczenia:
Właściwości utleniające dichromianu() potasu
Sprzęt i odczynniki:
dwie probówki;
wodny roztwór dichromianu() potasu;
stężony kwas siarkowy();
siarczan() sodu.
Instrukcja wykonania doświadczenia:
W probówce i umieszczono centymetry sześcienne wodnego roztworu dichromianu() potasu.
Do probówki wprowadzono kilka kropli stężonego kwasu siarkowego().
Do probówki i umieszczono centymetry sześcienne wodnego roztworu siarczanu() sodu.
Obserwowano zmiany.
Obserwacje:
W pierwszej probówce, po dodaniu siarczanu() sodu, nie zauważono zmian. W drugiej probówce, po dodaniu siarczanu() sodu, nastąpiła zmiana barwy roztworu z pomarańczowej na zieloną.
Wnioski:
W drugiej probówce atom chromu, występujący na stopniu utlenienia w dichromianie() potasu, zredukował się do stopnia utlenienia – powstała zielona sól chromu(). Co więcej, dichromian() potasu (a dokładnie atom chromu, występujący w tym związku na stopniu utlenienia), który wykazuje właściwości utleniające jedynie w środowisku kwasowym, utlenił jony siarczanowe() do jonów siarczanowych().
Równania reakcji chemicznych:
Słownik
reakcja, w której dochodzi do przeniesienia jednego lub więcej elektronów od atomu, jonu lub cząsteczki donora (czyli reduktora) do akceptora (czyli utleniacza)
pojęcie umowne, określające liczbę dodatnich lub ujemnych ładunków elementarnych, które można by przypisać atomowi pierwiastka chemicznego, wchodzącego w skład określonego związku, gdyby cząsteczki tego związku miały budowę jonową
(łac. reductio „cofnięcie”, „odzyskanie”) atom, jon lub cząsteczka, które w reakcji redoks są donorem elektronu (elektronów)
(fr. oxygéne, dosłownie „kwasoród”, „tlen”) atom, jon lub cząsteczka, które w reakcji redoks są akceptorem elektronu (elektronów)
proces przyjmowania elektronów, związany z obniżaniem stopnia utlenienia utleniacza
proces oddawania elektronów, związany z podwyższaniem stopnia utlenienia reduktora
Bibliografia
Jones L., Atkins P., Chemia ogólna: cząsteczki, materia, reakcje, Warszawa .
Litwin M., Styska‑Wlazło Sz., Szymońska J., To jest chemia Podręcznik dla liceum ogólnokształcącego i technikum, zakres rozszerzony, Warszawa .