Przeczytaj
Autodysocjacja wody
Woda ulega procesowi autodysocjacjiautodysocjacji według równania:
Proces autodysocjacji wody zachodzi w niewielkim stopniu i liczba powstających jonów oksoniowych i wodorotlenkowych jest niewielka. Najważniejsze w przypadku czystej wody jest jednak to, że stężenie jonów oksoniowych jest równe stężeniu jonów wodorotlenkowych.
pH roztworu to ujemny logarytm (o podstawie ) ze stężenia jonów oksoniowych:
pOH to z kolei ujemny logarytm (o podstawie ) ze stężenia jonów wodorotlenkowych:
Stężenie jonów hydroniowych można obliczyć znając pH i korzystając ze wzoru:
Pamiętajmy, że w temperaturze pH i pOH spełniają zależność:
Odczyn roztworów
W zależności od wartości pH roztwory możemy podzielić na:
roztwory o odczynieodczynie kwasowym jeżeli pH
roztwory o odczynie obojętnym jeżeli pH
roztwory o odczynie zasadowym jeżeli pH

Jak zmierzyć pH?
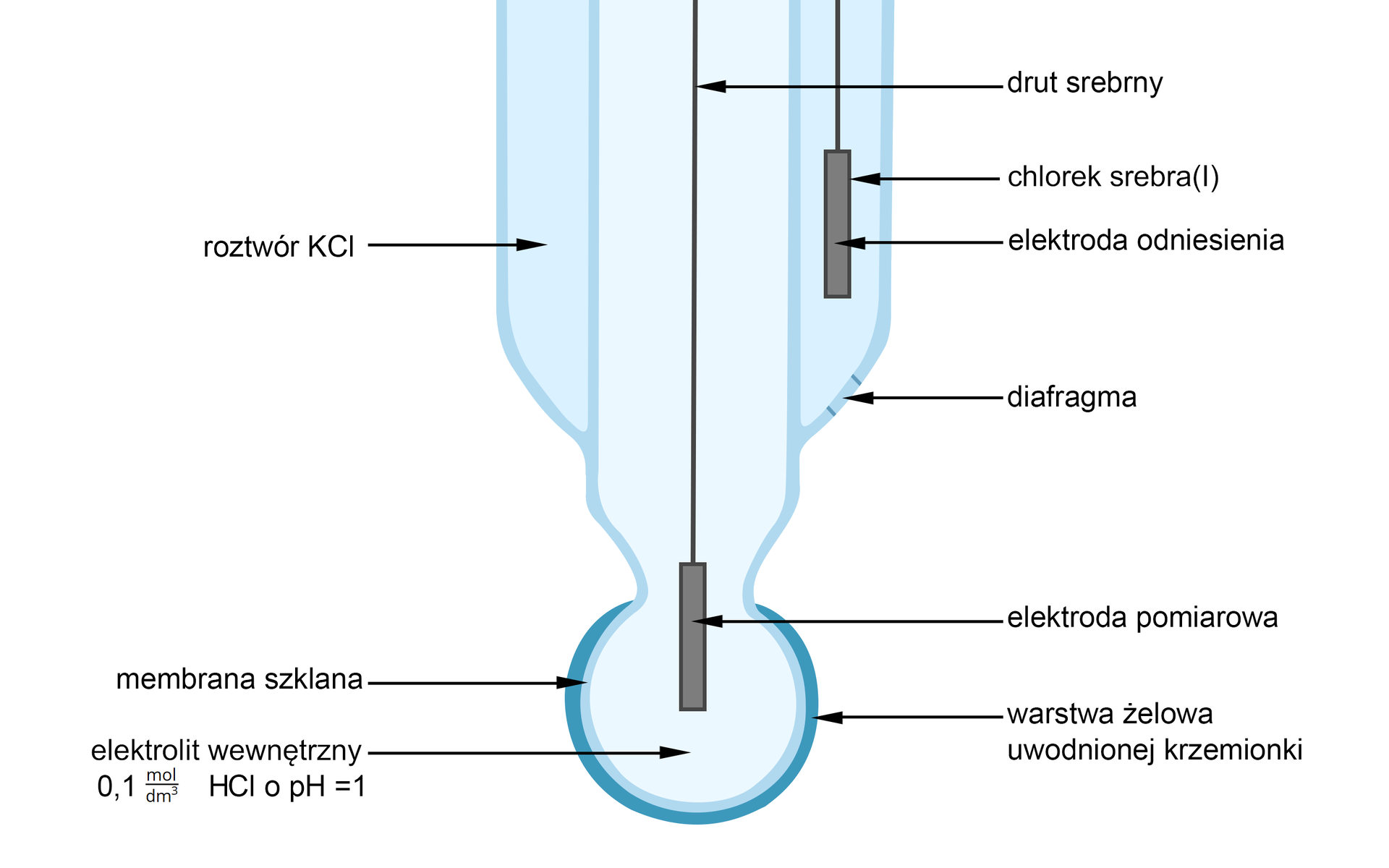
Działanie pH‑metru opiera się na pomiarze siły elektromotorycznej (SEM), na podstawie której określany jest potencjał. Urządzenie to pozwala na precyzyjne określenie pH roztworu. Składa się on z elektrody oraz miernika.
Metody elektrochemiczne należą do jednych z najbardziej precyzyjnych metod pomiarowych. W trakcie pomiaru układ musi być termostatowany. Oznacza to, że temperatura podczas pomiaru jest stała.
Przygotowanie aparatu do pomiaru
Pierwszym krokiem potrzebnym do wykonania pomiaru pH jest kalibracja pH‑metru. Wykonywana jest ona w celu zapewnienia dokładności pomiaru, ponieważ aktywność jonów oksoniowych zależy od temperatury. Większość nowoczesnych pH‑metrów ma dodatkową opcję kompensacji temperatury, dzięki czemu wpływ temperatury jest niwelowany. Aby wykalibrować pH‑metr są nam potrzebne roztwory wzorcowe, które możemy zakupić w sklepie chemicznym lub przygotować w laboratorium roztwory buforowe Britton’a–Robinson’aroztwory buforowe Britton’a–Robinson’a.
Elektroda jest elementem delikatnym, dlatego trzeba postępować bardzo ostrożnie.
Aby wykonać kalibrację postępuj zgodnie z instrukcją dołączoną do pH‑metru. Zwykle procedura kalibracji przebiega w następujacy sposób:
Wyciągnij elektrodę z naczynia z wodnym roztworem chlorku potasu, w którym jest ona zanurzona, a następnie przepłucz ją wodą destylowaną. Pozostałą na szklanej bańce wodę zbierz za pomocą bibuły.
Umieść elektrodę w roztworze buforowym, tak, aby w roztworze znalazł się punkt elektrody oznaczony na rysunku jako „diafragma”.
Naciśnij przycisk kalibracji i odczekaj do momentu, aż urządzenie poinformuje cię o zakończeniu pomiaru.
W zależności od rodzaju pH‑metru możemy kalibrować go na kilka roztworów buforowych, a im więcej użytych roztworów tym dokładniejsze wyniki pomiarów. Trzeba pamiętać o tym, aby przed każdym pomiarem przepłukać elektrodę wodą destylowaną i dokładnie osuszyć.
W celu prawidłowego działania pH‑metru kalibrację należy wykonać ściśle przestrzegając instrukcji dołączonej przez producenta.
Wykonanie pomiaru
Po wykonaniu kalibracji możesz przystąpić do pomiaru.
Pamiętaj, że każdy pomiar powinien być poprzedzony przemyciem elektrody i osuszeniem zgodnie z instrukcją opisaną w czasie kalibracji. Elektrodę należy oczyścić również po jej ostatnim użyciu, a przed ponownym jej umieszczeniem w roztworze .
Sam pomiar polega również na zanurzeniu elektrody w analizowanym roztworze (pamiętaj o konieczności zanurzenia diafragmy). Niektóre pH‑metry wymagają dodatkowo wciśnięcia odpowiedniego przycisku rozpoczynającego pomiar.
Przykłady zastosowania pH‑metru
- Nazwa kategorii: Przykłady zastosowania pH-metru
- Nazwa kategorii: pomiar wskaźników jakości wód
- Nazwa kategorii: pomiar pH gleby
- Nazwa kategorii: pomiar pH próbek biologicznych, np. moczu Koniec elementów należących do kategorii Przykłady zastosowania pH-metru
- Elementy należące do kategorii Przykłady zastosowania pH-metru
Słownik
dysocjacja elektrolityczna rozpuszczalnika amfoterycznego zachodząca z wymianą protonów między cząsteczkami rozpuszczalnika
ujemny logarytm dziesiętny ze stężenia jonów oksoniowych, wskaźnik odczynu roztworu
cecha roztworu, zależna od równowagi między jonami oksoniowymi i wodorotlenkowymi w roztworze.
jednododatni jon powstający w wyniku dołączenia się do cząsteczki wody jonu wodoru
element składowy pH‑metru, który po zanurzeniu w roztworze przesyła informację do mikroprocesora
roztwór buforowy służący do uzyskania pH od do , składa się on z roztworów , , o stężeniu . W celu uzyskania pożądanego pH miareczkuje się go roztworem o stężeniu
pH | pH | ||
|---|---|---|---|
— | — |
Bibliografia
Atkins P., Jones L., Chemia ogólna. Cząstki, materia, reakcje, Wydawnictwo Naukowe PWN, Warszawa, .
Encyklopedia PWN
https://pl.wikipedia.org/wiki/PH-metr (dostęp: 12.08.2021).
https://www.mt.com/dam/Analytical/pH-LabMeters/me-pdf/five/30266890_Operating_Instructions_pH_Bench_F20_FP20_PL.pdf (dostęp: 12.08.2021).