Przeczytaj
Woda jako kwas i zasada
Woda kranowa jest roztworem zawierającym jony pochodzące z dysocjacji rozpuszczonych w niej soli. Dobrze przewodzi prąd elektryczny, do czego przyczyniają się właśnie jony, które pochodzą z rozpuszczonych soli. Woda poddana kilkukrotnej destylacji staje się wodą zdejonizowaną, czyli taką, która bardzo słabo przewodzi prąd elektryczny, ponieważ została pozbawiona jonów rozpuszczonych w niej soli. W wodzie będą się nadal znajdować niewielkie liczby jonów oksioniowych () oraz wodorotlenkowych (). Jest to związane z jej autoprotoliząautoprotolizą, zachodzącą zgodnie z równaniem:

Powyższa reakcja pokazuje, że jedna cząsteczka wody zachowuje się jak zasada Brønsteda, ponieważ przyjmuje jon wodoru (), w wyniku czego staje się jonem oksoniowym (). Natomiast druga cząsteczka zachowuje się jak kwas Brønsteda, ponieważ oddaje jon wodoru (), w wyniku czego staje się jonem wodorotlenkowym (). Woda jest przykładem związku amfiprotycznegoamfiprotycznego – zachowuje się, jak kwas oraz zasada.
Strzałka oznacza stan równowagi termodynamicznej reakcji. A więc w pewnym momencie ustala się równowaga pomiędzy formami zdysocjowanymi i niezdysocjowanymi, co jest związane z tym, że tyle samo jonów i powstaje, co ulega ponownemu przekształceniu w cząsteczki wody.
Iloczyn stężeń jonów oksoniowych i wodorotlenkowych (tzw. iloczyn jonowy wody) jest zatem stały w danej temperaturze:
W temperaturze wynosi . Z iloczynu jonowego wody wynika, że w czystej wodzie stężenie jonów oksioniowych oraz stężenie jonów wodorotlenkowych wynosi w temperaturze . Jest ono tak małe, że woda zdejonizowana bardzo słabo przewodzi prąd elektryczny.
Woda jako zasada
Wiesz już, że woda jest związkiem amfiprotycznym, czyli może zachowywać się, jak kwas oraz zasada. W wyniku zmieszania kwasu z wodą zachodzi reakcja dysocjacji elektrolitycznejdysocjacji elektrolitycznej, dzięki której kwas rozpada się na odpowiednie jony. Przeanalizujemy równanie procesu dysocjacji, zapisane zgodnie z teorią Brønsteda–Lowry’ego:
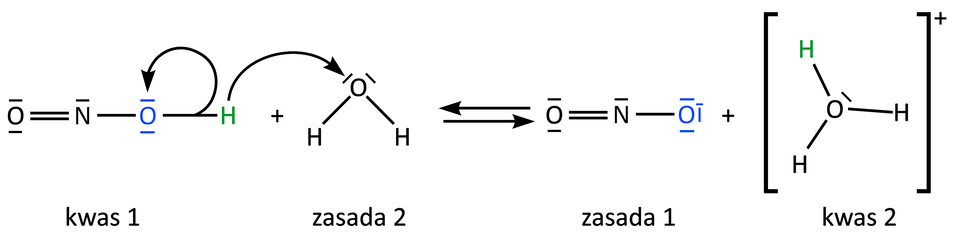
W wyniku reakcji dysocjacji kwasu azotowego(), para elektronowa tworząca wiązanie tlen–wodór zostaje w całości przyciągnięta do bardziej elektroujemnego atomu tlenu, w wyniku czego powstaje jon azotanowy() (). Uwolniony jon wodoru zostaje przyciągnięty przez wolną parę elektronową atomu tlenu cząsteczki wody, co w konsekwencji tworzy jon oksoniowy (). Zwróć uwagę, że dzięki reakcji dysocjacji i w myśl teorii Brønsteda–Lowry’ego powstają sprzężone pary kwasowo–zasadowe: kwas – zasada oraz zasada – kwas .
W myśl teorii kwasów i zasad Brønsteda–Lowry’ego, możemy stwierdzić:
kwas jest indywiduum chemicznym, który może oddać jon wodoru;
zasada jest indywiduum chemicznym, który może przyjąć jon wodoru;
pomiędzy kwasem i zasadą może zachodzić transfer jonu wodoru od kwasu do zasady, co określa się mianem reakcji protolitycznej;
w równaniu reakcji pomiędzy kwasem i zasadą można wyróżnić dwie sprzężone pary: kwas i sprzężona zasada, zasada oraz sprzężony kwas.
Zapisz równania dysocjacji elektrolitycznej następujących związków, zgodnie z teorią Brønsteda–Lowry’ego. Wskaż, które indywidua chemiczne odpowiadają za odczyn wodnego roztworu kwasu. Wskaż, jaką funkcję – kwasu czy zasady – pełni woda w tych dwóch poniżej zapisanych przypadkach.
Słownik
autojonizacja, autodysocjacja, dysocjacja elektrolityczna rozpuszczalnika amfiprotycznego zachodząca wskutek wymiany protonów między jego cząsteczkami
indywiduum chemiczne (cząsteczka, jon), które według teorii Brønsteda–Lowry'ego może — zależnie od środowiska reakcji — przyłączać lub odłączać proton(y)
iloczyn stężeń jonów powstałych w reakcji dysocjacji wody:
wyrażany wzorem:
gdzie — stężenie jonów i
samorzutny proces rozpadu indywiduów chemicznych (kwasów, zasad, soli) w roztworach na dodatnio i ujemnie naładowane cząstki, tj. jony
Bibliografia
Atkins P., Jones L., Chemia ogólna. Cząstki, materia, reakcje, Warszawa .
Bielański A., Podstawy chemii nieorganicznej, Warszawa .
Encyklopedia PWN
Housecroft C. E., Sharpe A. G., Inorganic Chemistry, Fourth edition, .