Przeczytaj
Powstawanie hydroksokompleksów
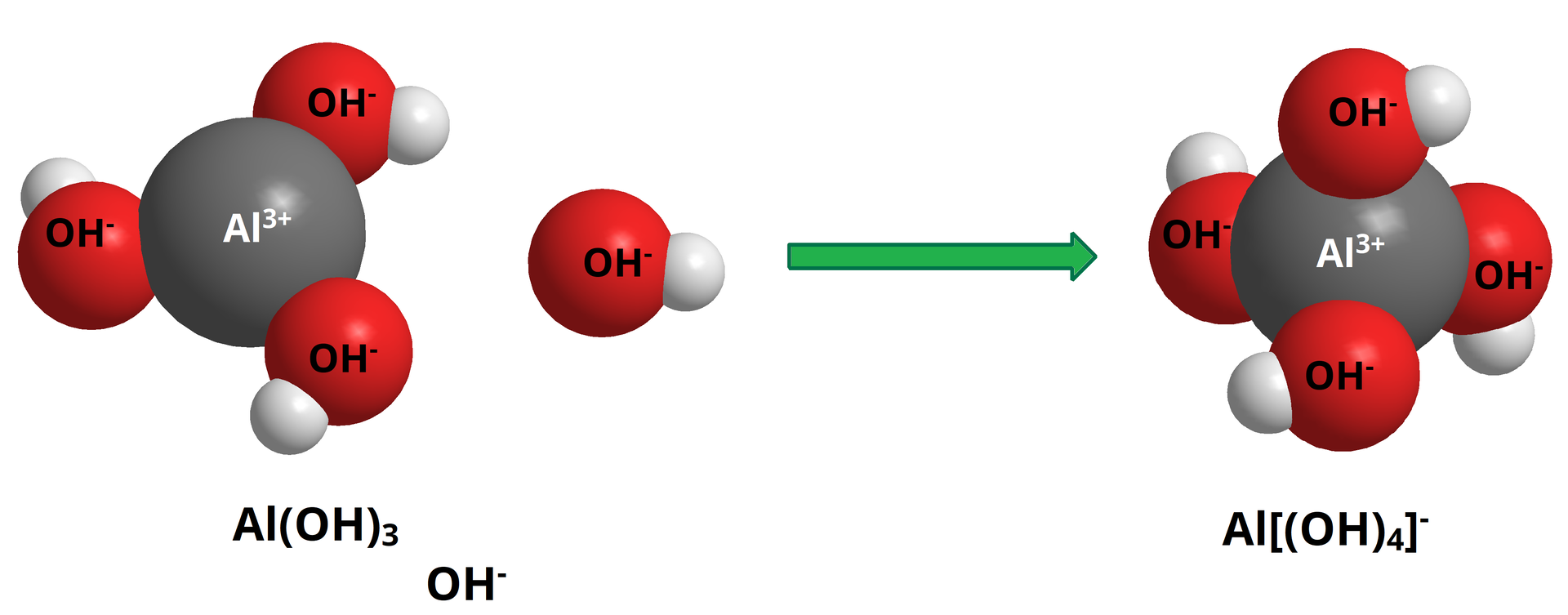
Osad trudno rozpuszczalnego wodorotlenku glinu można wytrącić z roztworu rozpuszczalnej soli glinu, np. chlorku lub siarczanu(), poprzez dodanie mocnej zasady, np. wodnego roztworu wodorotlenku sodu lub potasu. Początkowo wytrąca się biały, galeretowaty osad. Warto obliczyć, jaką ilość roztworu wodorotlenku należy użyć. W przypadku dodania większej ilości roztworu wodorotlenku, będącego mocnym elektrolitem, zaobserwujemy stopniowy zanik osadu, prowadzący do otrzymania klarownego bezbarwnego roztworu.
W pierwszym etapie następuje reakcja:
Powstały wodorotlenek glinu może reagować dalej z kolejnymi porcjami wodnego roztworu wodorotlenku (mocnego elektrolitu), dając rozpuszczalny produkt, nastąpi stopniowy zanik osadu, prowadzący do otrzymania klarownego bezbarwnego roztworu.
Powstający związek – tetrahydroksoglinian sodu – ze względu na budowę jonową ma charakter soli. W tym związku glin wchodzi w skład reszty kwasowej, co znaczy, że musi w przypadku tej reakcji odgrywać rolę kwasu.
Analogiczne właściwości przejawiają wodorotlenki: berylu, cynku oraz chromu():
Fakt, że niektóre indywidua chemiczne reagują zarówno z kwasami jak i zasadami, nosi nazwę amfoterycznościamfoteryczności. Podobne właściwości wykazują także wodorotlenki cyny i ołowiu na oraz stopniu utlenienia, a także wiele tlenków metali.
Wodorotlenki amfoteryczne
Niektóre wodorotlenki mogą reagować zarówno z kwasami, jak i wodnymi roztworami wodorotlenków:

W obydwu probówkach nastąpiło roztworzenie (zanik) osadu.
Wodorotlenek glinu reaguje z kwasami i zasadami. Wykazuje charakter amfoteryczny.
Amfoteryczność
Równania reakcji z kwasami oraz wodnymi roztworami wodorotlenków
-
Z kwasami
-
Z wodnymi roztworami wodorotlenków
-
-
-
W reakcji z kwasami Al(OH)3 zachowuje się jak zasada. W tych warunkach powstają sole Al3+.
-
W reakcji z wodnymi roztworami wodorotlenków Al(OH)3 zachowuje się jak kwas. W tych warunkach powstają aniony kompleksowe zawierające glin i jony wodorotlenkowe:
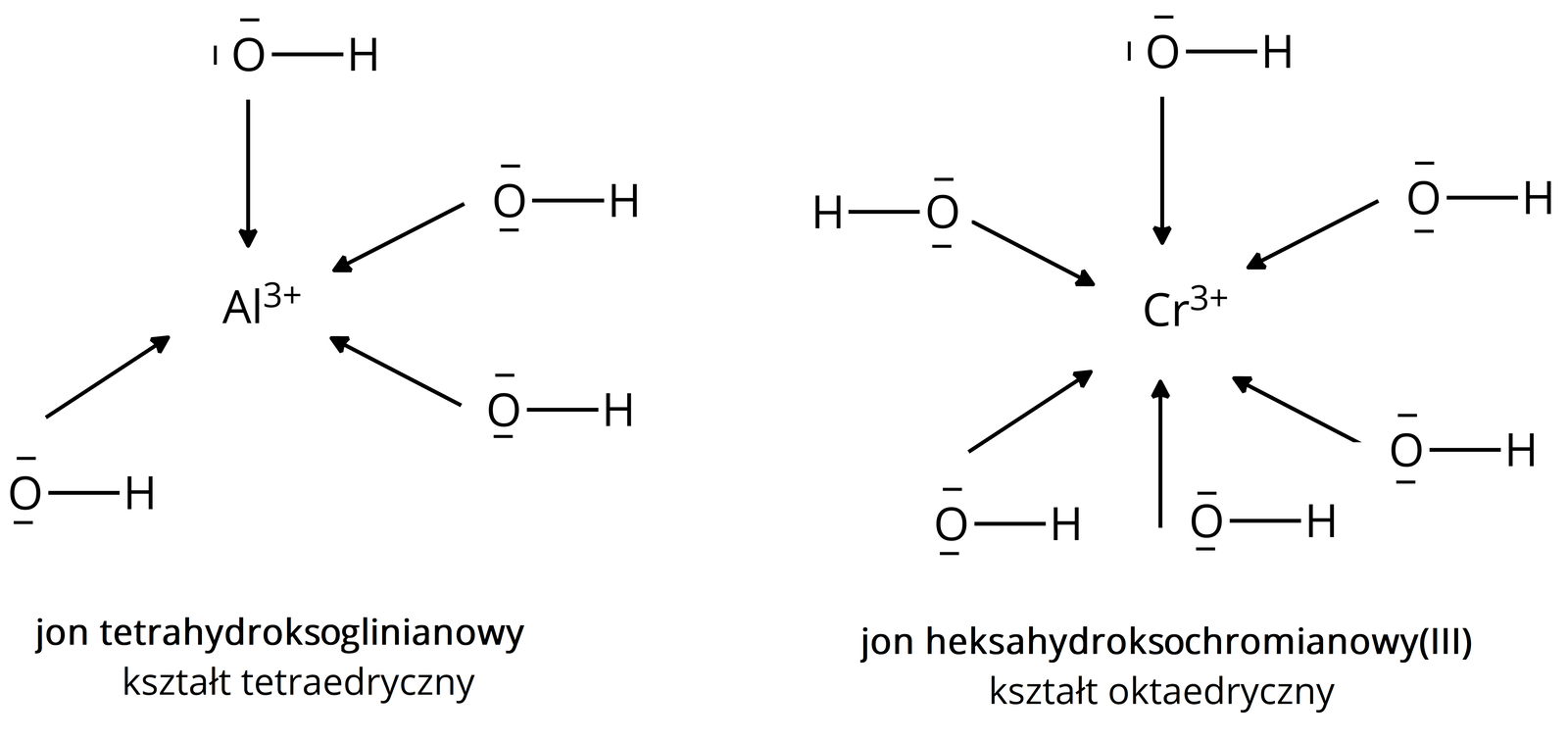
(anion tetrahydroksoglinianowy) lub:(aniony heksahydroksoglinianowe)
Wpływ wiązania na właściwości
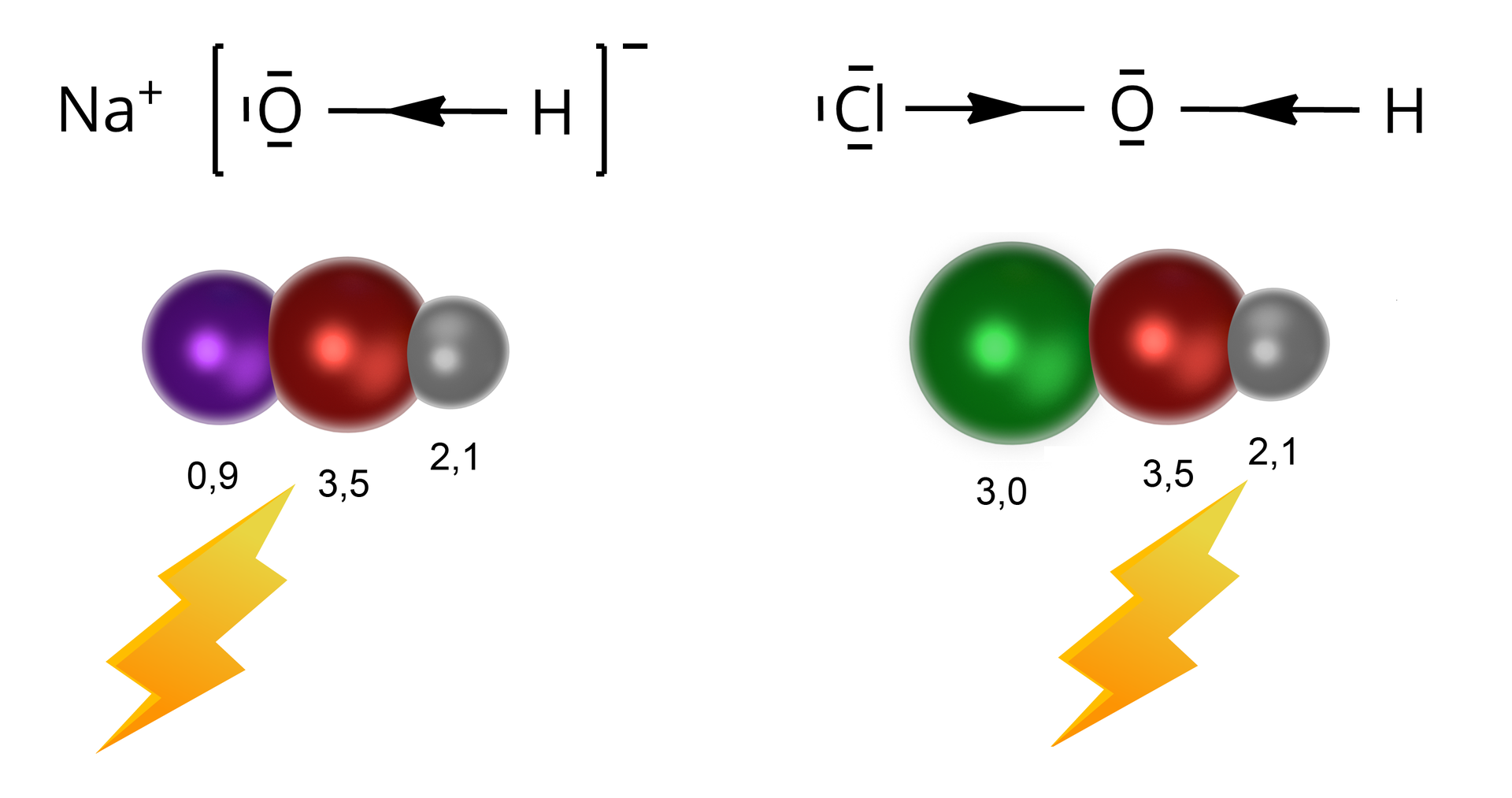
Im większy charakter jonowy wiązania (co wynika przede wszystkim z większej różnicy elektroujemności między atomami), tym większa preferencja do dysocjacji.
Związki amfoteryczne
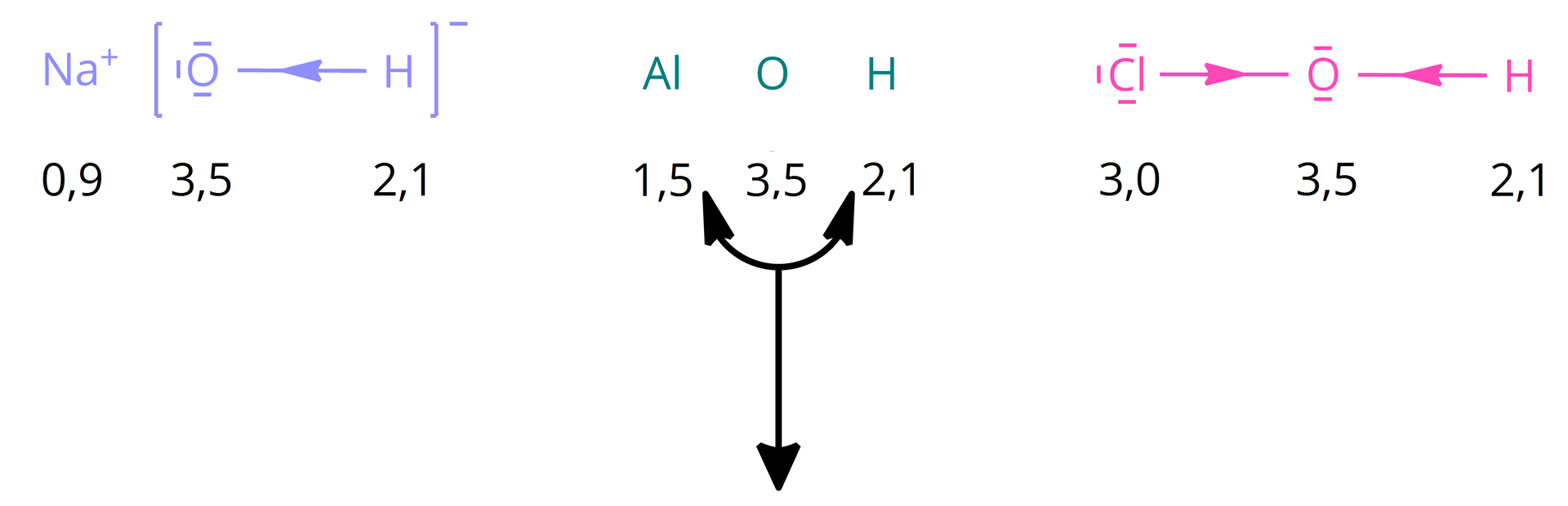
Zbliżona wartość różnicy elektroujemności między atomami oraz powoduje, że w zależności od warunków:
może nastąpić oderwanie jonu pod wpływem :
(reaguje jak zasada)może nastąpić przyłączenie jonu :
(reaguje jak kwas)
Budowa związków amfoterycznych
Wodorotlenki amfoteryczne posiadają niewielki, lecz wyraźny udział charakteru kowalencyjnego w wiązaniu . Mniejsza różnica wartości elektroujemności między atomem metalu a atomem tlenu sprawia, że elektrony z atomu metalu są słabiej przyciągane przez atom tlenu, a tym samym nie musi dochodzić do przejęcia elektronu metalu przez atom tlenu i powstania typowego wiązania domowego. Może też dojść do współdzielenia elektronów między tymi atomami, a więc powstania wiązania o charakterze kowalencyjnym. W związku z tym w związkach amfoterycznych wiązanie ma charakter pośredni pomiędzy kowalencyjnym a jonowym.

Z czego wynika amfoteryczność?
Wodorotlenek chromu() jest amfoteryczny, zaś wodorotlenek chromu() zasadowy. Z kolei tlenek chromu() wykazuje charakter kwasowy.
Jak to możliwe, skoro różnica elektroujemności jest wszędzie taka sama?
Właściwości tlenków chromu
Wodorotlenki amfoteryczne posiadają niewielki, lecz wyraźny przyczynek kowalencyjny w wiązaniu
Budowa hydroksokompleksów
Hydroksokompleksy należą do związków kompleksowychzwiązków kompleksowych, posiadają wiązanie koordynacyjnewiązanie koordynacyjne pomiędzy atomem tlenu a atomem metalu.
Słownik
właściwość polegające na uleganiu reakcji z kwasami tworząc sole i mocnymi zasadami tworząc związki koordynacyjne
liczba wiązań donorowo–akceptorowych (koordynacyjnych) utworzonych pomiędzy jonem centralnym a atomami donorowymi ligandów; dla kompleksów zawierających wyłącznie ligandy posiadające jeden atom donorowy (jednomiejscowe), liczba koordynacyjna jest równa liczbie ligandów
wiązanie utworzone poprzez przekazanie pary elektronowej od jednego atomu (donora, atomu donorowego) wchodzącego w skład liganda do jonu centralnego (akceptora)
jon lub obojętna cząsteczka zbudowana z atomu/jonu centralnego połączonego z ligandami za pomocą wiązań koordynacyjnych
1. obojętna cząsteczka kompleksu; 2. Związek o budowie jonowej, w którym co najmniej jeden jon jest kompleksem. Różnice między pojęciami „kompleks” a „związek kompleksowy” są następujące:
1. dla kompleksów o zerowym ładunku (niejonowych) pojęcia: „kompleks” i „związek kompleksowy” są tożsame;
2. dla kompleksów obdarzonych ładunkiem, „kompleks” dotyczy jonu zawierającego wiązania koordynacyjne, np. , natomiast „związek kompleksowy” dotyczy całej jednostki formalnej związku jonowego, którą można wyizolować, przykład:
Bibliografia
Bielański A., Podstawy Chemii nieorganicznej, t. , Warszawa .
Pac B., Zegar A., Podstawy klasyfikacji związków nieorganicznych w teorii i zadaniach, Kraków .
Pac B., Zegar A., Reakcje w roztworach wodnych w teorii i zadaniach, Kraków .