Przeczytaj
Uczeń na zajęciach laboratoryjnych z chemii wykonał doświadczenia chemiczne. Zapoznaj się z wykorzystanymi odczynnikami oraz obserwacjami, a następnie uzupełnij równania reakcji. Pamiętaj o dobraniu współczynników stechiometrycznych metodą bilansu jonowo‑elektronowego.
Dlaczego reakcja kwasu chlorowodorowego z miedzią nie zachodzi?
Elektroda | EIndeks górny 00 [V] |
|---|---|
-3,04 | |
-2,86 | |
-2,36 | |
-1,69 | |
-1,18 | |
-0,76 | |
-0,74 | |
-0,44 | |
-0,40 | |
-0,28 | |
-0,26 | |
-0,14 | |
-0,14 | |
-0,04 | |
0,00 | |
+0,32 | |
+0,34 | |
+0,80 | |
+0,85 | |
+1,52 |
Indeks górny Źródło: D. Witowski, Chemia‑zbiór zadań z odpowiedziami dla kandydatów na uniwersytety medyczne i kierunki przyrodnicze zdających maturę z chemii 2002‑2019, Oficyna Wydawnicza Nowa Matura Indeks górny koniecŹródło: D. Witowski, Chemia‑zbiór zadań z odpowiedziami dla kandydatów na uniwersytety medyczne i kierunki przyrodnicze zdających maturę z chemii 2002‑2019, Oficyna Wydawnicza Nowa Matura
Analizując powyższy szereg elektrochemiczny metaliszereg elektrochemiczny metali można zauważyć, że cynk, magnez i wapń charakteryzują się ujemnymi wartościami potencjałów standardowychpotencjałów standardowych, natomiast miedź dodatnim, a wodór zerowym. Metale o ujemnej wartości standardowych potencjałów są silniejszymi reduktoramireduktorami niż wodór, natomiast metale o dodatniej wartości potencjałów standardowych są silniejszymi utleniaczamiutleniaczami. Miedź znajduje się w szeregu elektrochemicznym metali poniżej wodoru, oznacza to, że jest silniejszym utleniaczemutleniaczem niż wodór.
Samorzutność reakcji można przewidzieć na podstawie standardowych potencjałów elektrod. Pierwiastki o ujemnych potencjałach wykazują zdolność do redukowania jonów wodorowych w roztworze kwasu do gazowego wodoru i uleganiują utlenieniu. Natomiast pierwiastki o dodatnich wartościach potencjałów standardowych nie mogą redukować jonów wodorowych i wydzielać gazowego wodoru z roztworu kwasu.
Utleniacze i reduktory są uszeregowane na podstawie potencjałów standardowych elektrod mierzonych względem standardowej elektrody wodorowej. Im większa wartość potencjału standardowego, tym mniejsza jest zdolność utleniająca elektrody. Na podstawie potencjałów standardowych elektrod można przewidzieć czy reakcja jest samorzutna.
Jak przewidzieć przebieg reakcji chemicznej? – wypieranie metali z roztworu jego soli
Korzystając z szeregu elektrochemicznego metali określ, w których probówkach zaszły reakcje.
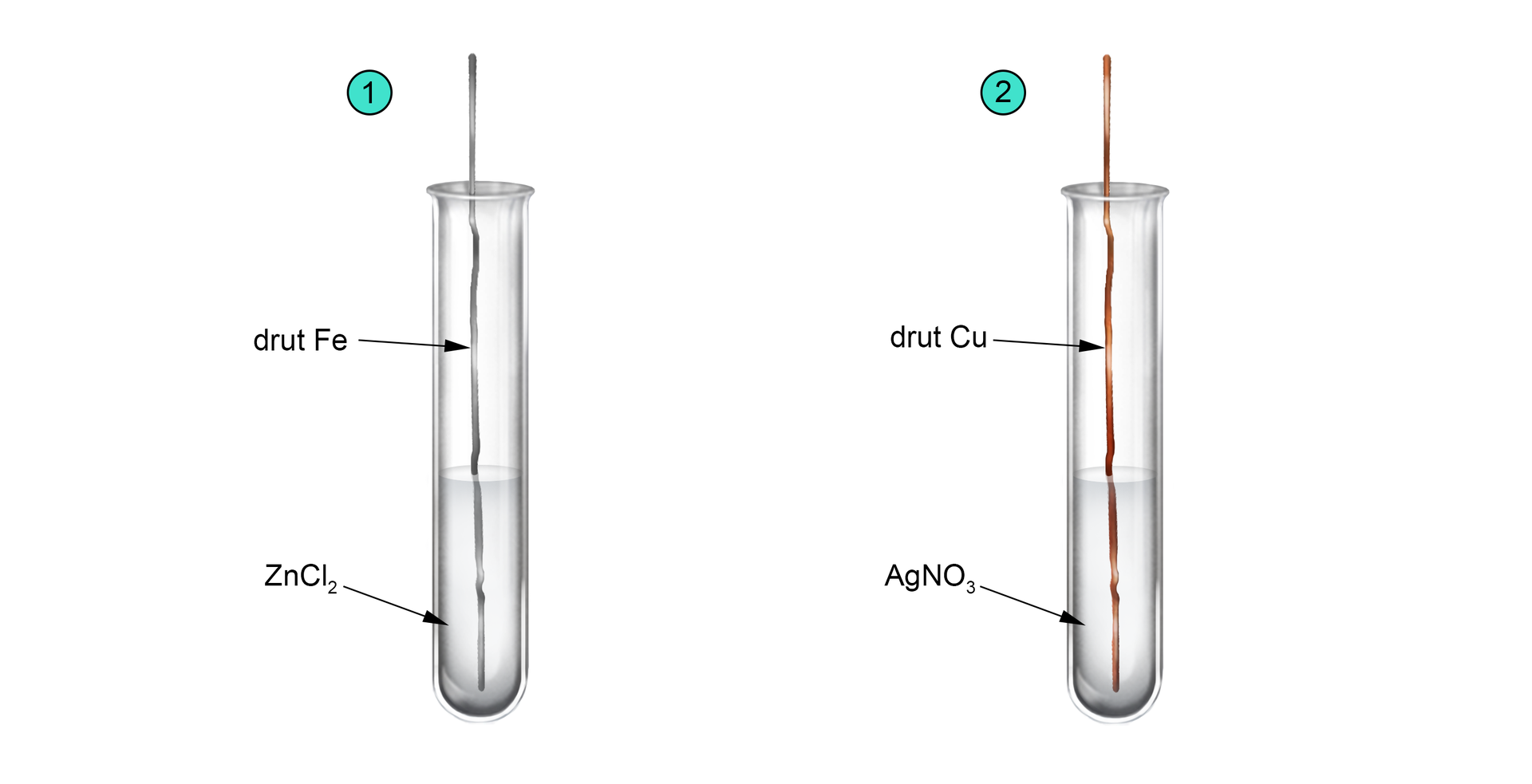
Probówka nr 1.
i , w celu określenia czy dana reakcja zajdzie należy porównać aktywności kationów cynku i drutu wykonanego z żelaza. Cynk znajduje się powyżej żelaza w szeregu elektrochemicznym metali (ma niższy potencjał standardowy), czyli reakcja nie zajdzie, ponieważ żelazo nie wyprze cynku z jego soli.
Zapisz równanie reakcji chemicznej oraz dokonaj bilansu jonowo‑elektronowego.
1. Ag+, 2. zajdzie, 3. Cu, 4. Ag+, 5. nie zajdzie, 6. NO3-, 7. NO3- Cu w szeregu elektrochemicznym, czyli reakcja 1. Ag+, 2. zajdzie, 3. Cu, 4. Ag+, 5. nie zajdzie, 6. NO3-, 7. NO3-.
Zapisz równanie reakcji chemicznej oraz dokonaj bilansu jonowo‑elektronowego.
Słownik
reakcje chemiczne, w wyniku których atomy lub jony zmieniają swoje stopnie utlenienia poprzez wymianę elektronów
donor elektronów w reakcjach redoks
akceptor elektronów w reakcjach redoks
reakcja chemiczna, w której atomy lub jony tracą elektrony
reakcja chemiczna, w której atomy lub jony pobierają elektrony
siła elektromotoryczna ogniwa, w którym drugą elektrodą jest elektroda wodorowa, której przypisuje się potencjał równy zeru. Dla anody potencjał standardowy jest ujemny, a dla katody dodatni
tablica przedstawiająca względną moc utleniaczy i reduktorów
Bibliografia
Bielański A., Podstawy chemii nieorganicznej, t. 2, Warszawa 2013.