Przeczytaj
Charakterystyka pierwiastków bloku układu okresowego pierwiastków

Do bloku należą pierwiastki znajdujące się w grupach – układu okresowego.
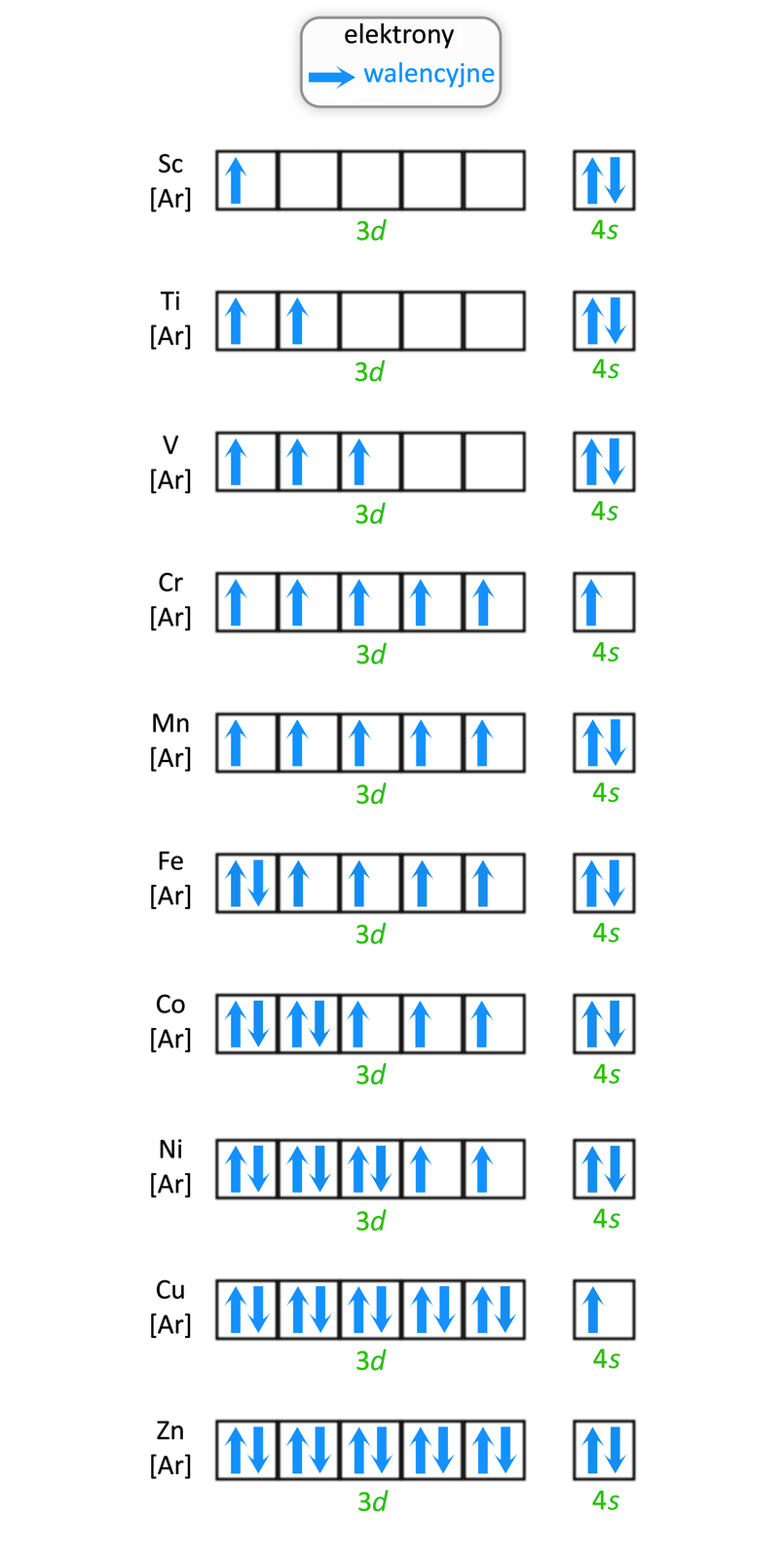
Zapisz pełne podpowłokowe konfiguracje elektronowe dla atomów wybranych metali bloku w stanie podstawowym, tj.: , , , , , i zastanów się, jakie typowe stopnie utlenienia (wynikające bezpośrednio z konfiguracji elektronowej) będą przyjmować atomy tych pierwiastków w związkach chemicznych?
Konfiguracje elektronowe atomów metali bloku położonych w okresie układu okresowego
Zmiana właściwości pierwiastków z bloku wraz ze wzrostem numeru grupy lub okresu
Miedź
Złoto
Jony i są trwałe tylko w związkach trudno rozpuszczalnych w wodzie.
W roztworach wodnych ulegają dysproporcjonowaniu:
A jony powstające we wspomnianym procesie ( i ) są trwałe właśnie w roztworach wodnych.
Zabarwienie związków metali bloku . Większość z nich ma intensywne zabarwienie. Jest ono związane z możliwością pochłaniania światła w obszarze widzialnym przez elektrony przemieszczające się w obrębie podpowłoki .
Metal | Jon | Kolor wodnego roztworu jonów |
|---|---|---|
zielony lub niebieski | ||
brunatny | ||
fioletoworóżowy | ||
zielony | ||
niebieski | ||
bezbarwny |
Metale szlachetne
Spośród metali bloku , te, które są najmniej aktywne i najbardziej odporne chemicznie, nazwano metalami szlachetnymimetalami szlachetnymi. Zalicza się do nich platynowce: ruten, rod, pallad, osm, iryd i platynę, oraz dwa metale z grupy miedziowców, czyli srebro i złoto. Miedź, ze względu na nieco wyższą reaktywność, zalicza się do metali półszlachetnych.
Metale szlachetne bardzo słabo reagują z innymi pierwiastkami, prawie nie ulegają korozji, nie reagują z wodą, nie roztwarzają się w większości kwasów, są odporne na działanie stężonego kwasu chlorowodorowego i innych kwasów beztlenowych – nie wypierają wodoru z kwasów. Metale te ulegają działaniu kwasów silnie utleniających lub wodzie królewskiejwodzie królewskiej, będącej mieszaniną stężonych kwasów – kwasu chlorowodorowego i kwasu azotowego().


Słownik
zwyczajowa nazwa odpornych chemicznie metali, tj.: iryd i platyna, srebro i złoto
szereg napięciowy; uszeregowanie pierwiastków chem. w kolejności wzrastającej zdolności do przyjmowania przez nie (lub ich kationy) elektronów w reakcjach utleniania‑redukcji (redoks)
(łac. aqua regia „woda królewska”) mieszanina kwasów o bardzo silnych właściwościach utleniających (i roztwarzających np. złoto), w której skład wchodzą stężony kwas chlorowodorowy i kwas azotowy(V) w stosunku objętościowym
Bibliografia
Atkins P. Jones L., Chemia ogólna, Warszawa 2004, s. 969–1011.
Czerwińska A., Jelińska–Kazimierczuk M., Kuśmierczyk K., Chemia 1. Podręcznik, Warszawa 2002, s. 280–360.
Kałuża B., Kamińska F., Chemia. Podręcznik. Część 1. Zakres rozszerzony, Warszawa 2013, s. 362–292.
Trzebiatowski W., Chemia nieorganiczna, Warszawa 1977, s. 354–355.