Przeczytaj
Klasyfikacja tlenków ze względu na budowę
TlenkiTlenki to związki tlenu z innymi pierwiastkami, w których atomy tlenu występują na
stopniu utlenieniastopniu utlenienia. Istnieje kilka sposobów klasyfikacji tlenków. Związki pierwiastków z tlenem można podzielić na tlenki, nadtlenki i ponadtlenki.
- Nazwa kategorii: Związki pierwiastków z tlenem
- Nazwa kategorii: tlenki
- Nazwa kategorii: proste
- Nazwa kategorii: np. N a indeks dolny, dwa, koniec indeksu dolnego, O – tlenek sodu Koniec elementów należących do kategorii proste
- Nazwa kategorii: mieszane
- Nazwa kategorii: np. F e indeks dolny, trzy, koniec indeksu dolnego, O indeks dolny, cztery, koniec indeksu dolnego – tlenek żelaza(dwa, trzy), N indeks dolny, dwa, koniec indeksu dolnego, O – tlenek azotu(jeden, dwa) N indeks dolny, dwa, koniec indeksu dolnego, O indeks dolny, trzy, koniec indeksu dolnego – tlenek azotu(cztery, dwa) Koniec elementów należących do kategorii mieszane
- Nazwa kategorii: ponadtlenki
- Nazwa kategorii: np. K O indeks dolny, dwa, koniec indeksu dolnego – ponadtlenek potasu, N a O indeks dolny, dwa, koniec indeksu dolnego – ponadtlenek sodu Koniec elementów należących do kategorii ponadtlenki
- Nazwa kategorii: nadtlenki
- Nazwa kategorii: np. H indeks dolny, dwa, koniec indeksu dolnego, O indeks dolny, dwa, koniec indeksu dolnego – nadtlenek wodoru, N indeks dolny, dwa, koniec indeksu dolnego, O indeks dolny, dwa, koniec indeksu dolnego – nadtlenek sodu, B a O indeks dolny, dwa, koniec indeksu dolnego – nadtlenek baru Koniec elementów należących do kategorii nadtlenki
- Nazwa kategorii: fluorki
- Nazwa kategorii: np. O F indeks dolny, dwa, koniec indeksu dolnego Koniec elementów należących do kategorii fluorki
- Elementy należące do kategorii Związki pierwiastków z tlenem
- Elementy należące do kategorii tlenki
- Elementy należące do kategorii proste
- Elementy należące do kategorii mieszane
- Elementy należące do kategorii ponadtlenki
- Elementy należące do kategorii nadtlenki
- Elementy należące do kategorii fluorki
Wzór ogólny tlenków prostych ma postać:
gdzie:
– oznacza symbol dowolnego pierwiastka chemicznego;
, – odpowiednie indeksy stechiometryczne.
Do ustalenia reaktywności tlenków kluczowy jest ich podział ze względu na ich charakter chemiczny. Wyróżniamy tlenki:
obojętne, np. , – nie ulegają reakcji z kwasamikwasami ani z wodnymi roztworami wodorotlenków;
kwasowe, np. :
reagują z wodnymi roztworami wodorotlenków, tworząc sole, np.:
nie ulegają reakcji z kwasami, np.:
reakcja nie zachodzi
zasadowe, np. :
reagują z kwasami, tworząc sole, np.:
nie ulegają reakcji z wodnymi roztworami wodorotlenków, np.:
reakcja nie zachodzi
amfoteryczne, np. :
reagują z mocnymi kwasami, np.:
reagują z wodnymi roztworami wodorotlenków, które są mocnymi elektrolitami, np.:
Ze względu na zachowanie tlenków wobec wody, wyróżniamy:
niereagujące z wodą;
reakcja nie zachodzireakcja nie zachodzireagujące z wodą.
kwasotwórcze – reagują z wodą, tworząc kwasy tlenowekwasy tlenowe, np.:
zasadotwórcze – reagują z wodą, tworząc zasady, np.:
Reakcje zachodzące między odpowiednimi tlenkami a wodą, kwasami lub wodnymi roztworami wodorotlenków, można zapisać na trzy sposoby. Pierwszy z nich to klasyczny sposób zapisu równania reakcji w formie cząsteczkowej, drugi to zapis w formie jonowej pełnej, a trzeci – w formie jonowej skróconej.
Cząsteczkowa forma zapisu równania reakcji polega na zapisie symboli pierwiastków, wzorów cząsteczek oraz związków jonowych z ustalonymi współczynnikami. Przykładowo:
Druga forma zapisu równania reakcji polega na przedstawieniu wszystkich możliwych reagentów danej reakcji w postaci jonów.
Aby poprawnie zapisać takie równanie, konieczne jest zaznajomienie się z regułami dotyczącymi tej formy zapisu. W formie jonów zapisuje się wszystkie substancje dobrze rozpuszczalne (mocne kwasy, wodorotlenki będące mocnymi elektrolitami i sole), z kolei związki takie jak:
tlenki,
słabe kwasy (np. ),
słabe zasady (np. ),
trudno rozpuszczalne oraz nierozpuszczalne sole (np. ),
trudno rozpuszczalne i nierozpuszczalne wodorotlenki (np. ),
trudno rozpuszczalne i nierozpuszczalne kwasy (np. ),
zapisuje się w formie cząsteczkowej. Ponadto, woda również jest zawsze zapisywana jest w postaci cząsteczkowej – .
Gdzie sprawdzić, czy otrzymany produkt będzie związkiem trudno rozpuszczalnym lub nierozpuszczalnym w wodzie?
Do określenia służy tabela rozpuszczalności soli i wodorotlenków w wodzie i w danej temperaturze. W tej zamieszczonej poniżej, lewa kolumna zawiera przykłady kationów, a z kolei pierwszy wiersz przykłady anionów. Właściwe połączenie par kationów i anionów wskazuje, jak dany związek rozpuszcza się w wodzie. Informuje o tym legenda umieszczona obok.
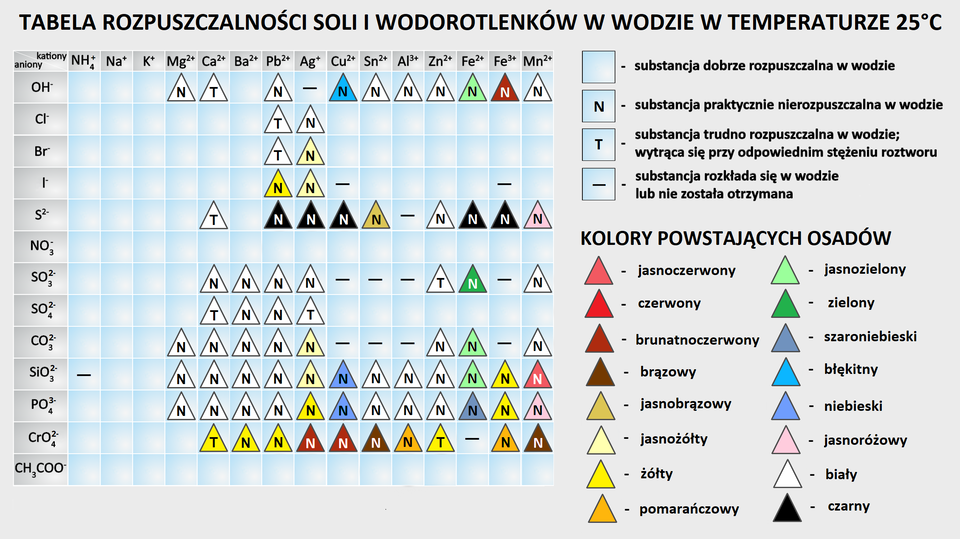
W jaki sposób zapisuje się równanie reakcji w formie jonowej pełnej i jonowej skróconej?
Po pierwsze należy zastanowić się, jaki charakter chemiczny ma dany tlenek, następnie należy zapisać i uzgodnić równanie reakcji w formie cząsteczkowej, np.:
Następnie należy sprawdzić, czy reagenty ulegają w roztworze wodnym dysocjacji jonowej i zastosować się do przedstawionych reguł. Otrzymujemy pełny zapis równania reakcji w formie jonowej pełnejrównania reakcji w formie jonowej pełnej:
W miejsce jonów możecie oczywiście użyć jonów .
Następnie należy skrócić jony, występujące po obydwu stronach równania. Dzięki temu zapis równania w formie jonowej skróconej wygląda następująco:
Jony, które usuwa się z zapisu równania reakcji, nie mają wpływu na jej przebieg.
Zapisz poniższe równania w formie cząsteczkowej, jonowej pełnej oraz jonowej skróconej:
tlenek magnezu + woda;
tlenek sodu + kwas solny;
tlenek siarki + wodorotlenek sodu.
1. , 2. , 3. , 4. , 5. , 6. , 7. + 1. , 2. , 3. , 4. , 5. , 6. , 7. 2 +
1. , 2. , 3. , 4. , 5. , 6. , 7. + 1. , 2. , 3. , 4. , 5. , 6. , 7. 1. , 2. , 3. , 4. , 5. , 6. , 7. +
Słownik
dwuskładnikowe związki tlenu z innymi pierwiastkami, w których atomy tlenu występują na stopniu utlenienia
ładunek jonu, w jaki przekształciłby się atom danego pierwiastka, gdyby wszystkie tworzone przez niego wiązania miały charakter jonowy
związek chemiczny zbudowany z kationów metalu i anionów wodorotlenkowych
związek chemiczny zbudowany z jednego atomu (lub atomów) wodoru i reszty kwasowej
związek chemiczny, zbudowany z jednego atomu (lub atomów) wodoru i reszty kwasowej zawierającej atom (lub atomy) niemetalu i atom (lub atomy) tlenu
reakcja chemiczna, w której udział biorą m.in. jony
Bibliografia
Encyklopedia PWN
Hejwowska S., Marcinkowski R., Chemia ogólna i nieorganiczna, Gdynia .
Reakcje jonowe - jak je zapisać?, online: http://joannaroga.pl/reakcje-jonowe-jak-je-zapisac/, dostęp: 07.12.2021.
www.rebusy.edu.pl/