Przeczytaj
Właściwości fizyczne wodorków fluorowców
W postaci pierwiastkowej fluor i chlor są gazami, brom łatwo parującą cieczą, a jod ciałem stałym. Jaki jest stan skupienia związków tych pierwiastków z wodorem? Jak można wytłumaczyć tak znaczącą różnicę?
Temperatury wrzenia fluorowcowodorów
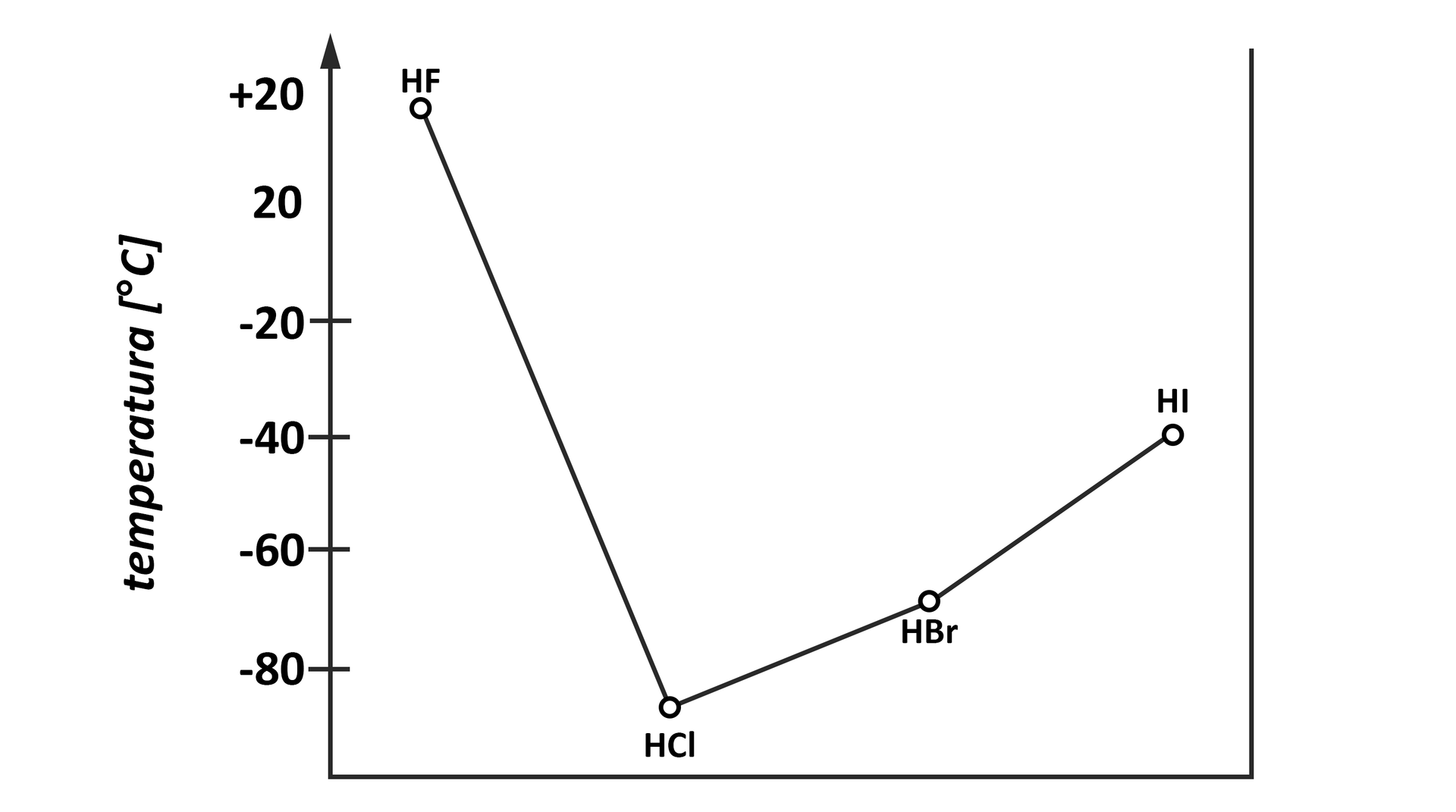
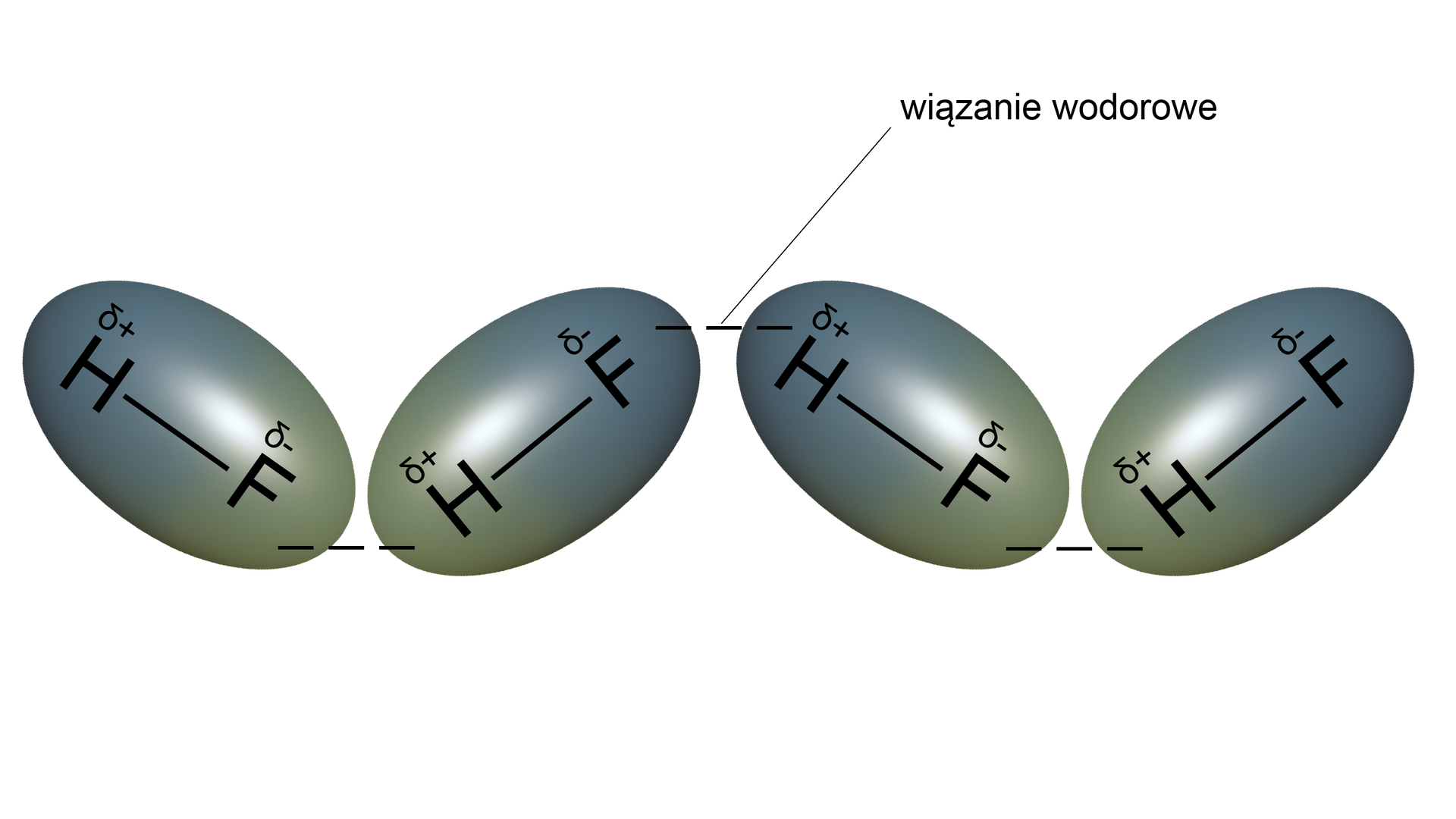
Wysoka temperatura wrzenia fluorowodoru wynika z tworzenia się wiązań wodorowychwiązań wodorowych pomiędzy cząsteczkami .
Rozpuszczalność fluorowcowodorów w wodzie
Jak zachowują się wodorki fluorowców wobec wody? Czy rozpuszczają się w wodzie, a może reagują z nią?
Wszystkie fluorowcowodory są dobrze rozpuszczalne w wodzie (w warunkach normalnych), a fluorowodór miesza się z wodą w dowolnym stosunku.
Fluorowcowodór | Rozpuszczalność w wodzie |
Fluorowodór | całkowicie mieszalny (ciecz) |
Chlorowodór | |
Bromowodór | |
Jodowodór |
Roztwory wodne wodorków fluorowców mają odczyn kwasowy.
O czym to świadczy?
W roztworach wodnych fluorowcowodory ulegają dysocjacji elektrolitycznej. Za odczyn kwasowy odpowiedzialny jest nadmiar jonów oksoniowych , które powstają w wyniku reakcji z wodą:
Otrzymane roztwory są mocnymi kwasami, z których tylko kwas fluorowodorowy jest kwasem słabym .
Moc kwasów beztlenowych pierwiastków grupy układu okresowego rośnie (w dół grupy) wraz ze wzrostem liczby atomowej:
Wodorki fluorowców – zarówno w roztworach wodnych, jak i w stanie gazowym – reagują z wodorotlenkami, dając sole. Dla przykładu:
Fluorowodór wyróżnia się spośród innych wodorków pierwiastków grupy układu okresowego, ponieważ posiada właściwości żrące i silnie toksyczne.
Fluorowodór w formie gazowej reaguje z węglowodorami nienasyconymi, tworząc odpowiednie fluoropochodne węglowodorów. Stosowany jest do produkcji freonów, teflonu i fluoropochodnych związków organicznych.

Reakcja gazowego chlorowodoru z amoniakiem

Czy można tę reakcję wyjaśnić, stosując teorię kwasów i zasad?
Reakcja gazowego chlorowodoru z gazowym amoniakiem jest reakcją kwasu z zasadą w rozumieniu teorii Brønsteda. W tej reakcji chlorowodór jest donorem jonu wodoru (zapisanego tu jako ), a amoniak jego akceptorem.
Nie jest to reakcja, do której interpretacji można posłużyć się teorią Arrheniusa. Ta dotyczy bowiem tylko wodnych roztworów chlorowodoru i amoniaku.
Słownik
(łac. associatio „połączenie”, „związek”) odwracalne łączenie się cząstek chemicznych (cząsteczek, jonów, atomów) w większe układy (tzw. asocjaty), złożone z dwóch lub większej liczby cząstek
oddziaływanie międzycząsteczkowe lub wewnątrzcząsteczkowe z udziałem atomu wodoru
Bibliografia
Bielański A., Podstawy chemii nieorganicznej, Warszawa 1987, s.571‑574.
Mizerski T., Tablice chemiczne, Warszawa 2008, s. 72.
Sawicka J., Janich‑Kilian A., Cejnert‑Mania W., Urbańczyk G., Tablice chemiczne, Gdańsk 2002, s. 227‑234.
Pac B., Zegar A., Podstawy klasyfikacji związków nieorganicznych w teorii i zadaniach, Kraków 2019.