Symulacja interaktywna
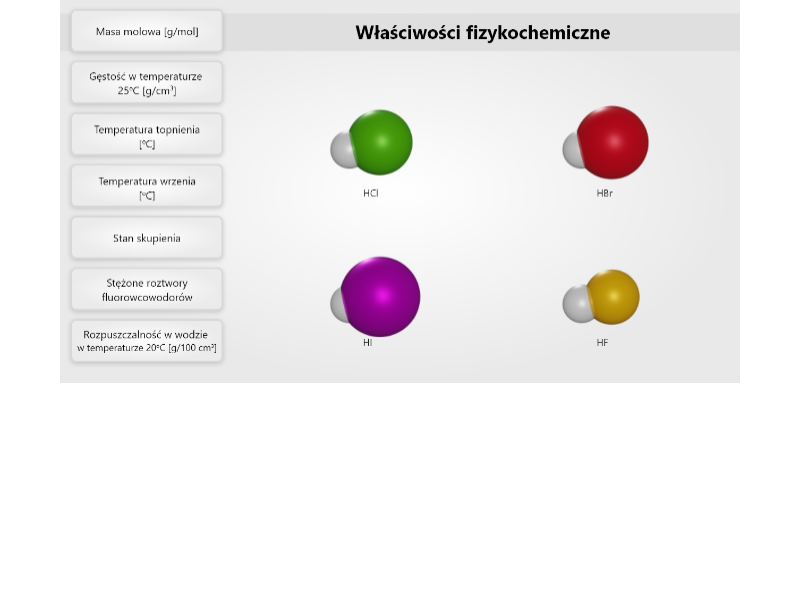
Przeanalizuj poniższą symulację. Zwróć uwagę, jak zmieniają się właściwości fizykochemiczne wodorków pierwiastków grupy, a następnie rozwiąż ćwiczenia sprawdzające.
Zapoznaj się z opisem symulacji. Zwróć uwagę, jak zmieniają się właściwości fizykochemiczne wodorków pierwiastków grupy, a następnie rozwiąż ćwiczenia sprawdzające.
Zasób interaktywny dostępny pod adresem https://zpe.gov.pl/a/DgNbxl1vl
Przeanalizuj dane zawarte w symulacji i odpowiedz na poniższe pytanie.
W jaki sposób zmieniają się temperatury topnienia i wrzenia wodorków fluorowców, w zależności od położenia fluorowców w układzie okresowym?
W trzech probówkach znajdowało się po -molowego, wodnego roztworu, odpowiednio: w probówce , w probówce , probówce . Zbadano odczyn tych roztworów oraz ich pH. W której z probówek stwierdzono najniższą wartość pH?