Przeczytaj
Czym jest stała równowagi?
W każdej odwracalnej reakcji chemicznejodwracalnej reakcji chemicznej może ustalić się stan równowagi.
Jest on opisywany przez wartość stałej równowagi Kstałej równowagi K, która to z kolei jest równa ilorazowi reakcji w stanie doskonałej równowagi, tj. w sytuacji, gdy szybkość reakcji, w stronę od substratów do produktów i od produktów do substratów, jest dokładnie taka sama. Stała K jest przypisana dla konkretnych wartości temperatury oraz ciśnienia. Czynniki zewnętrzne mogą przesuwać stan równowagi w stronę produktów lub substratów.
Jak ciśnienie wpływa na położenie stanu równowagi?
W tej części rozważymy wpływ ciśnienia na położenie stanu równowagi.
Reakcja syntezy – kiedy z kilku substratów powstaje jeden produkt
Rozważmy hipotetyczną reakcję:
Wszystkie reagenty są w stanie gazowym, przy stałym ciśnieniu i temperaturze. Bilansując (uzgadniając) równanie reakcji zauważymy, że liczba moli substratów (4 mole) jest różna od ilości moli produktów (dwa mole). Synteza związku powoduje zmniejszenie się ilości reagentów. Zakłócenie stanu równowagi, poprzez zwiększenie ciśnienia, przesunie równowagę w stronę syntezy produktu, ponieważ układ dąży do powrotu do stanu równowagi. Zmniejszenie ciśnienia natomiast będzie miało skutek odwrotny – przesunięcie równowagi w stronę substratów.
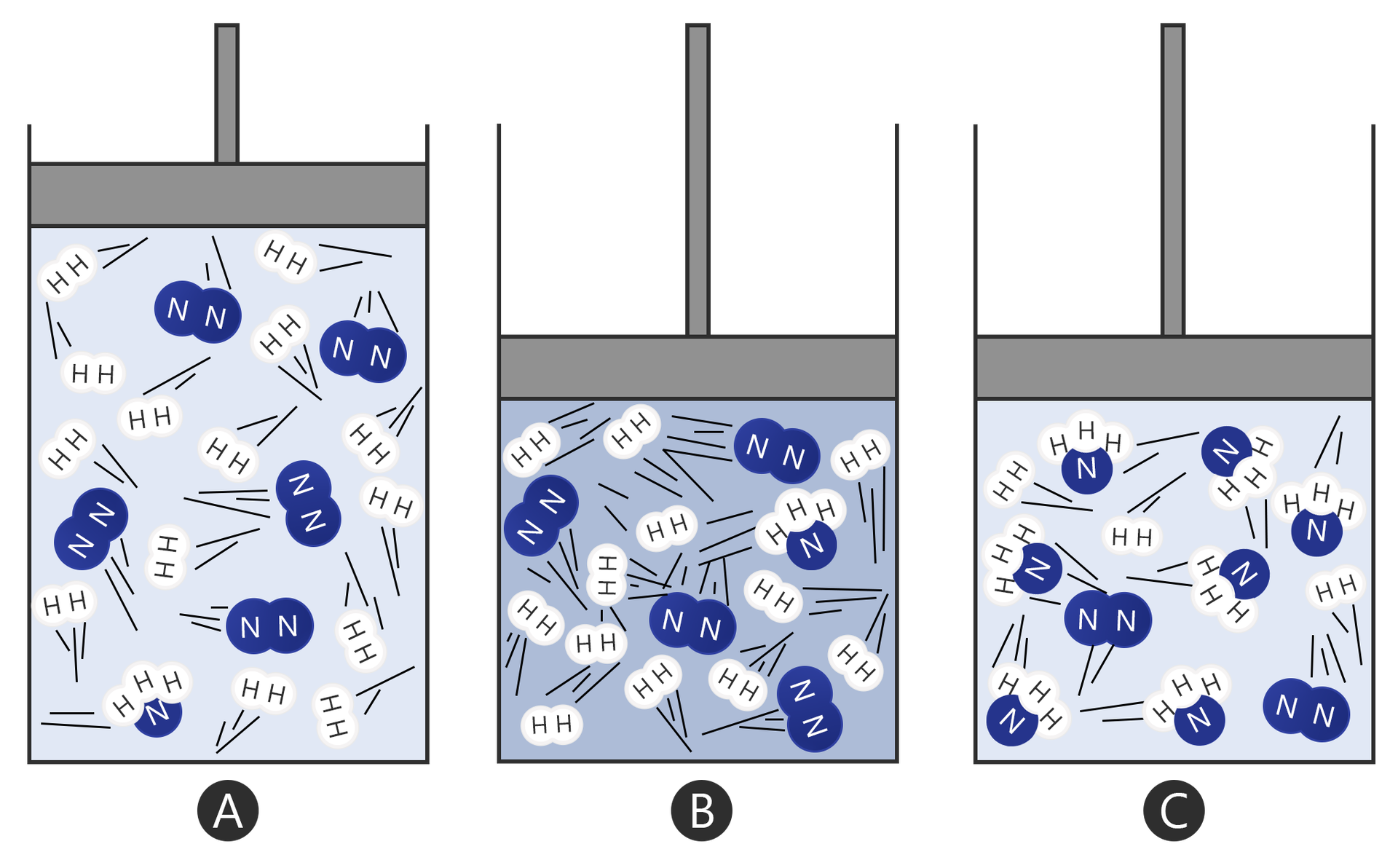
B) Poprzez opuszczenie tłoka zwiększa się ciśnienie w układzie. Cząsteczki zaczynają poruszać się szybciej, przez co prawdopodobieństwo ich zderzenia jest większe, a tym samym także zajścia reakcji.
C) Ustala się stan równowagi. Przeważają głównie cząsteczki produktu.

Podwyższenie ciśnienia wodoru oraz azotu w reaktorach powoduje zwiększenie wydajności procesu syntezy amoniaku do około 30%. MetodęMetodę syntezy amoniaku opracował niemiecki fizykochemik, Fritz Haber, za co w 1918 r. otrzymał nagrodę Nobla. Współcześnie ocenia się, że nawozy azotowe, produkowane przy użyciu tej metody, są odpowiedzialne za produkcję żywności, która utrzymuje przy życiu ok. jedną trzecią ludzkości. Wytwarzanie amoniaku jest procesem bardzo energochłonnym – produkcja 1 t bezwodnego amoniaku pochłania 1000–1250 gazu ziemnego. Na wytwarzanie amoniaku zużywa się ok. 5% światowej produkcji gazu ziemnego i ok. 2% energii.
Reakcja analizy – kiedy z jednego substratu powstaje kilka produktów
Rozważmy hipotetyczną reakcję:
Wszystkie reagenty są w stanie gazowym przy stałym ciśnieniu i temperaturze. Bilansując (uzgadniając) równanie reakcji zauważymy, że liczba moli substratów jest różna od ilości moli produktów. Poprzez rozkład związku A otrzymuje się dwa mole produktów, co powoduje zwiększenie ilości reagentów. Zakłócenie stanu równowagi reakcji przez zmniejszenie ciśnienia powoduje przesunięcie równowagi w kierunku produktów. Zmiana ciśnienia w drugą stronę powoduje skutek odwrotny – przesunięcie równowagi w kierunku substratów.
Reakcja bez zmiany objętości
Rozważmy hipotetyczną reakcję:
Wszystkie reagenty są w stanie gazowym, przy stałym ciśnieniu i temperaturze. Bilansując równanie reakcji zauważymy, że liczba moli substratów jest równa liczbie moli produktów. W wyniku reakcji z dwóch moli substratów powstają dwa mole produktów. W związku z czym nie zmienia się objętość reagentów, a co za tym idzie – zmiana ciśnienia nie powoduje przesunięcia stanu równowagi.
Reakcje dwufazowe
Rozważmy hipotetyczną reakcję:
Reagenty są w stanie stałym oraz gazowym. Po stronie produktów są trzy mole gazu (dwa mole C i jeden mol D). Zakłócenie stanu równowagi przez zwiększenie ciśnienia przesunie równowagę w stronę syntezy produktu. Z kolei zmniejszenie ciśnienia będzie miało skutek odwrotny – przesunięcie równowagi w stronę substratów.
Reakcje z inertnym indywiduum w formie gazowej
Wprowadzenie do układu reakcyjnego gazu inertnegogazu inertnego powoduje zmniejszenie stężenia reagentów w układzie. Z tego względu maleją również ciśnienia cząstkoweciśnienia cząstkowe, a co za tym idzie – zmniejsza się ciśnienie ogólne w układzie. Dlatego dodanie gazu inertnego powoduje przesunięcie stanu równowagi tak samo, jak obniżenie ciśnienia ogólnego. Jest on zatem korzystny dla reakcji analizy, natomiast niekorzystny dla reakcji syntezy.
Słownik
reakcja chemiczna złożona z elementarnych procesów, które przebiegają jednocześnie w przeciwnych kierunkach: . Produkty reakcji przebiegającej z lewa na prawo są substratami reakcji biegnącej w kierunku przeciwnym i odwrotnie
ciśnienie, jakie wywierałby na ścianki naczynia składnik mieszaniny gazów doskonałych, gdyby sam zajmował całą objętość tego naczynia
substancja, która nie reaguje z żadnym z reagentów w danych warunkach
synteza amoniaku na skalę przemysłową w warunkach wysokiego ciśnienia oraz temperatury
odpowiada ilorazowi reakcji w stanie doskonałej równowagi, tj. w sytuacji, gdy szybkość reakcji, w stronę od substratów do produktów i od produktów do substratów, jest dokładnie taka sama
Bibliografia
Encyklopedia PWN
Chemia. Temat 14: Kinetyka chemiczna. Semestr 1, Wydzał Przyrodniczo - Techniczny KPSW http://chemia.wpt.kpswjg.pl/semestr1/temat14/ [dostęp 09.12.2012]
Roszkowski A., Technologie produkcji zwierzęcej a emisje gazów cieplarnianych, „Problemy Inżynierii Rolniczej” 2011, nr 2.
Wolfe D. W., Tales from the underground: a natural history of subterranean life, Cambridge, Massatschussets 2001.