Przeczytaj
Charakterystyka cynku
Cynk to pierwiastek chemiczny, będący metalem należącym do bloku układu okresowego pierwiastków. Zajmuje miejsce pod względem rozpowszechnienia w skorupie ziemskiej. Występuje w liczbie aż izotopów, z których zaledwie jest trwałych.
W Polsce największe złoża jego rud znajdują się w Górnośląskim Zagłębiu Węglowym (okolice Olkusza). Na świecie liderem produkcji cynku są Chiny ( udziału w rynku światowym).
Cynk naturalnie występuje w postaci minerałów, wśród których najważniejszymi są blenda cynkowa (sfaleryt) oraz wurcyt. Obydwa minerały to dwie różne odmiany krystalograficzne siarczku cynku (). Blenda cynkowa to odmiana regularnaodmiana regularna, wurcyt stanowi odmianę heksagonalnąodmianę heksagonalną.
Zjawisko, w którym substancja chemiczna występuje w odmiennych postaciach krystalograficznych, nosi nazwę polimorfizmu. Wśród innych składowych rud zawierających cynk są produkty wietrzenia blendy cynkowej, czyli: hydrocynkit , spinel cynkowy .
Ponadto cynk występuje także w minerale o nazwie smitsonit (). Należy do głównych składników rud galmanowych.
Pokaz slajdów. Zdjęcie przedstawia dłoń trzymającą sfaleryt, czyli blendę cynkową, ciemnobrązowy minerał z jasnobrązowymi pasami – siarczek cynku. Podpis. Sfaleryt – blenda cynkowa. Następne zdjęcie przedstawia wurcyt. Dość rzadki, czarny, połyskliwy minerał z białymi refleksami. Podpis. Wurcyt. Następne zdjęcie przedstawia hydrocynkit. Rzadko występujący, rdzawoczerwony minerał z białymi i szarymi refleksami. Podpis. Hydrocynkit. Następne zdjęcie przedstawia smitsonit – jasnobłękitny minerał. Podpis. Smitsonit.
W jaki sposób można otrzymać cynk?
Cynk można otrzymać w wyniku metody pirometalurgicznej (metoda ogniowa) oraz hydrometalurgicznej. Pierwsza z nich jest stopniowo wycofywana, jednak jej zmodernizowana wersja, wykorzystująca angielski piec (ISF), jest nadal ważna. W jej wyniku na drodze prażenia (–) dochodzi do przemiany siarczku cynku w tlenek cynku.
Następnie w zamkniętych muflach szamotowych tlenek redukuje się węglem (–).
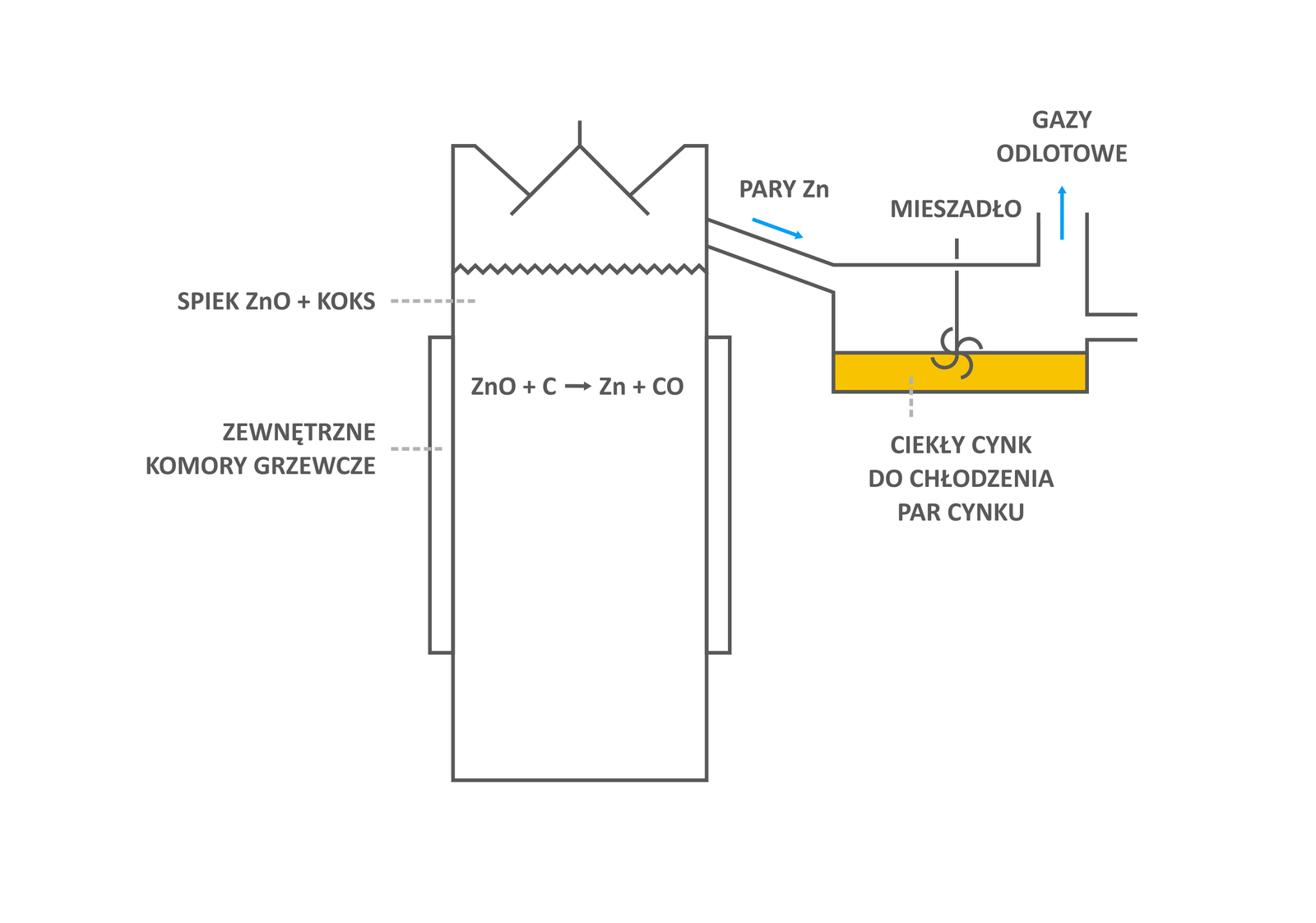
Proces ten prowadzony jest w temperaturze zdecydowanie wyższej niż temperatura wrzenia tego metalu (), dlatego też cynk wydzielany jest w postaci par, które następnie skraplają się w ceramicznym odbieralniku łączącym się z muflą oraz w metalowym pojemniku (), gdzie kondensuje w postaci pyłu cynkowego. Tak otrzymany cynk surowy jest zanieczyszczony ołowiem, kadmem oraz żelazem. W celu jego oczyszczenia przeprowadza się rafinację, na przykład na drodze frakcjonowanej destylacji.

Kolumny do tego procesu zawierają dużą ilość ogniotrwałych półek. Dolne ich końce ogrzewane są z zewnątrz gazem ziemnym. Natomiast górne są chłodne po to, aby skroplić i zawrócić metale o wyższych temperaturach wrzenia.
Destylacja ta przebiega w dwóch etapach. Początkowo następuje oddzielenie cynku i kadmu od ołowiu. W tym celu ciekły cynk jest doprowadzony do pierwszej kolumny, a tam wraz z kadmem jest oddestylowywany. W drugim etapie odbywa się oddzielenie kadmu od cynku. Mieszanina ta ulega skropleniu i trafia do drugiej kolumny (o niższej temperaturze), z której wydzielany jest kadm w postaci stopu cynkiem.
W wyniku etapu drugiego otrzymywany jest cynk wysokogatunkowy (SHG) o czystości . W pierwszym natomiast metal (GOB), który zawiera zanieczyszczenia w postaci: ołowiu, cyny, arsenu, żelaza, antymonu i miedzi.

Metoda hydrometalurgiczna rozpoczyna się podobnie, czyli od wyprażenia rud siarczkowych. Proces ten przebiega w temperaturze , dlatego w jego wyniku otrzymywany jest tlenek cynku i siarczan() cynku. Następnie wyprażoną rudę poddaje się ługowaniu rozcieńczonym kwasem siarkowym() i dla otrzymanego roztworu przeprowadza się elektrolizę. W jej wyniku na katodzie wydzielany jest cynk, a na anodzie tlen. Katodę stanowi aluminiowa blacha, a anodę – ołów (lub stop ołowiu z srebra). Na katodzie zachodzi redukcja cynku:
Na anodzie utlenianie:
Całość procesów podsumowuje poniższe równanie:
Z równania reakcji wynika, że jednym z produktów powinien być kwas siarkowy(). Tak jednak się nie dzieje, ponieważ proces przerywany jest zanim cały cynk ulegnie wydzieleniu. Powodem tego są różne procesy uboczne towarzyszące zmianie składu elektrolitu w trakcie elektrolizy. Niewykorzystany w pełni elektrolit wykorzystywany jest do ponownego wytrawiania rudy.
Porównując obydwa procesy, należy podkreślić, że proces hydrometalurgiczny dostarcza cynk o większej czystości i jest procesem znacznie bardziej ekonomicznym niż proces pirometalurgiczny.
Z punktu widzenia warunków fizykochemicznych, elektroliza wodnego roztworu siarczanu cynku, zgodnie z szeregiem napięciowym metaliszeregiem napięciowym metali, powinna prowadzić do wydzielenia się wodoru (wyższy potencjał standardowy) na katodzie przed cynkiem. Jednak ze względu na nadnapięcienadnapięcie wodoru, jego wydzielenie, m.in. na cynku (oraz na aluminium), jest możliwe dopiero po zastosowaniu wyższych napięć. Dlatego też, sterując odpowiednio napięciem elektrolizującym (), można otrzymać w tym procesie cynk przed wodorem. Kluczowe w tym aspekcie są czynniki, takie jak:
gładka powierzchnia katody (wówczas nadnapięcie wodoru jest większe);
odpowiednie stężenie jonów cynku (ich niedobór obniża nadnapięcie, należy mieszać roztwór elektrolitu);
czystość wydzielanego cynku (utrzymuje wysokie nadnapięcie wodoru);
temperatura (wzrost powoduje obniżenie nadnapięcia);
dodatek w postaci koloidów (powoduje wzrost nadnapięcia wodoru);
gęstość prądu (większa gęstość skutkuje wyższym nadnapięciem).
Zastosowanie cynku
Cynk stosowany jest głównie jako powłoka chroniąca stal przed korozją. Stal ocynkowana niewątpliwie kojarzy się każdemu z konstrukcjami metalowymi i produkcją samochodów. Poza tym cynk stanowi składnik mosiądzu, czyli stopu tego metalu z miedzią, który stosowany jest np. do produkcji łożysk ślizgowych i armatury okrętowej. Co więcej, stosowany jest w przemyśle: oponiarskim (w postaci tlenku cynku() pełni rolę aktywatora wulkanizacji), chemicznym, farmaceutycznym, kosmetycznym, nawozów sztucznych, farbiarskim oraz do produkcji baterii (cynkowo‑węglowych oraz alkalicznych).
Ponadto jako ciekawostkę można dodać, że biel cynkową () stosował Van Gogh podczas malowania swoich obrazów. Przykładem dzieła, w którym został on użyty, jest obraz pod tytułem Pole pszenicy z cyprysami. Ponadto siarczek cynku występował w pigmencie zwanym litopon (mieszanina , ).

Słownik
zwane inaczej nadpotencjałem, stanowi różnicę między potencjałem elektrody spolaryzowanej a jej potencjałem równowagowym (zwanym potencjałem spoczynkowym)
(inaczej szereg elektrochemiczny, szereg aktywności metali) jest to zestawienie pierwiastków metalicznych pod względem wartości ich potencjałów standardowych, w szeregu punkt odniesienia stanowi elektroda wodorowa o potencjale standardowym równym zero
jest to siła elektromotoryczna ogniwa, które zbudowane jest z odwracalnego półogniwa badanego, posiadającego jony o jednostkowej aktywności, czyli o stężeniu jonu równym
układ krystalograficzny, w którym pojedyncza komórka ma każdą oś jednakowej długości i są one względem siebie równolegle ułożone; komórka w tym układzie krystalicznym zbliżona jest wyglądem do sześcianu

układ krystalograficzny, w którym pojedyncza komórka ma trzy osie jednakowej długości ułożone względem siebie pod kątem , a czwarta jest innej długości i jest do nich prostopadła; komórka w tym układzie krystalicznym zbliżona jest wyglądem do graniastosłupa o podstawie w kształcie rombu

(gr. polys ,,wiele'', morfe ,,kształt'') występowanie tej samej pod względem składu chemicznego substancji w dwóch lub więcej odmianach krystalicznych. Odmiany te różnią się między sobą budową wewnętrzną
Bibliografia
Bielański A., Podstawy chemii nieorganicznej, Warszawa 1994.
Encyklopedia PWN
Hejwowska S., Marcinkowski R., Równowagi i procesy jonowe, Gdynia 2005.