Przeczytaj
Glin (symbol Al – łac. Aluminium) to pierwiastek, który należy do 13. grupy układu okresowego pierwiastków, tzw. borowców.

Właściwości fizyczne glinu
Metaliczny pierwiastek glin, czyli technicznie aluminium, jest drugim po żelazie metalem ze względu na mnogość swoich zastosowań w gospodarce człowieka.
Zapoznaj się z danymi w poniższej tabeli i wskaż najważniejsze właściwości różniące glin od żelaza.
własność | jednostka | ||
|---|---|---|---|
liczba atomowa | - | 13 | 26 |
ciężar atomowy | - | 26,9815 | 55,8450 |
struktura krystaliczna | - | A1 | A1 * |
gęstość w 20°C | 2,6989 | 7,8740 | |
temperatura topnienia | °C | 660,40 | 1534,85 |
temperatura wrzenia | °C | 2520,00 | 2749,85 |
współczynnik rozszerzalności cieplnej | 10Indeks górny -6-6 | 18 | 11 |
przewodność cieplna | 247,0 | 80,2 | |
przewodność elektryczna | 37,74 | 9,93 | |
wydłużenie | % | 50 | 30 - 50 |
twardość Mohsa | 2,9 | 4,0 | |
właściwości magnetyczne | - | paramagnetyk | ferromagnetyk |
* Występują odmiany alotropowe (w temperaturze pokojowej A2)
Indeks dolny Banaszek M., Praca dyplomowa, Warszawa 2010. Indeks dolny koniecBanaszek M., Praca dyplomowa, Warszawa 2010.

Zbadaj wybrane właściwości fizyczne glinu: stan skupienia oraz barwę. Uzupełnij poniższą tabelę.
Stan skupienia, Barwa, Rozpuszczalność w wodzie, Połysk, Kowalność, Przewodnictwo cieplne, ciekły, gazowy, srebrzystoróżowa, srebrzystoszara, żółta, rozpuszczalny, niekowalny, brak przewodnictwa cieplnego
| Cecha | Odpowiedź |
|---|---|
| Stan skupienia | |
| Barwa | |
| Rozpuszczalność w wodzie | |
| Połysk | |
| Kowalność | |
| Przewodnictwo cieplne |
Inne właściwości fizyczne glinu:
na powietrzu szybko matowieje;
bardzo dobrze przewodzi prąd elektryczny (62% przewodności elektrycznej miedzi);
ciągliwy – można go rozciągać i rozwalcowywać do bardzo cienkich warstw (do 0,004 mm);
kruchy;
łamliwy;
nierozpuszczalny w rozpuszczalnikach organicznych.
temperatura topnienia | temperatura wrzenia | ||
|---|---|---|---|
[K] | [°C] | [K] | [°C] |
933,46 | 660,3 | 2793,16 | 2520,0 |
Mizerski W., Tablice szkolne, Warszawa 2011.
Poniżej zostały podane wartości gęstości: glinu, sodu, magnezu, żelaza, chromu, niklu oraz cynku. Porównaj gęstość glinu z innymi metalami. Uzupełnij poniższe zdanie, wybierając i podkreślając jedno z określeń, które są podane w nawiasach.
Glin | Sód | Magnez | Żelazo | Chrom | Nikiel | Cynk | |
|---|---|---|---|---|---|---|---|
Gęstość | 2,70 | 0,97 | 1,74 | 7,87 | 7,17 | 8,91 | 7,14 |
Mizerski W., Tablice szkolne, Warszawa 2011.
Gęstość glinu jest ({mniejsza} / {#większa}) od gęstości magnezu. Gęstość glinu jest ({#mniejsza} / {większa}) od gęstości żelaza. Metale lekkie to metale, których gęstość jest mniejsza od 4,5 g/cm3. Porównując gęstość glinu z innymi metalami, można wysunąć wniosek, że glin jest metalem ({#lekkim} / {ciężkim}).
Właściwości fizyczne glinu wynikają z występującego w nim wiązania metalicznegowiązania metalicznego. Elektrony walencyjneElektrony walencyjne, które pochodzą od wszystkich atomów, tworzą wspólną chmurę elektronową i oddziaływują z dodatnio naładowanymi rdzeniami atomowymi.
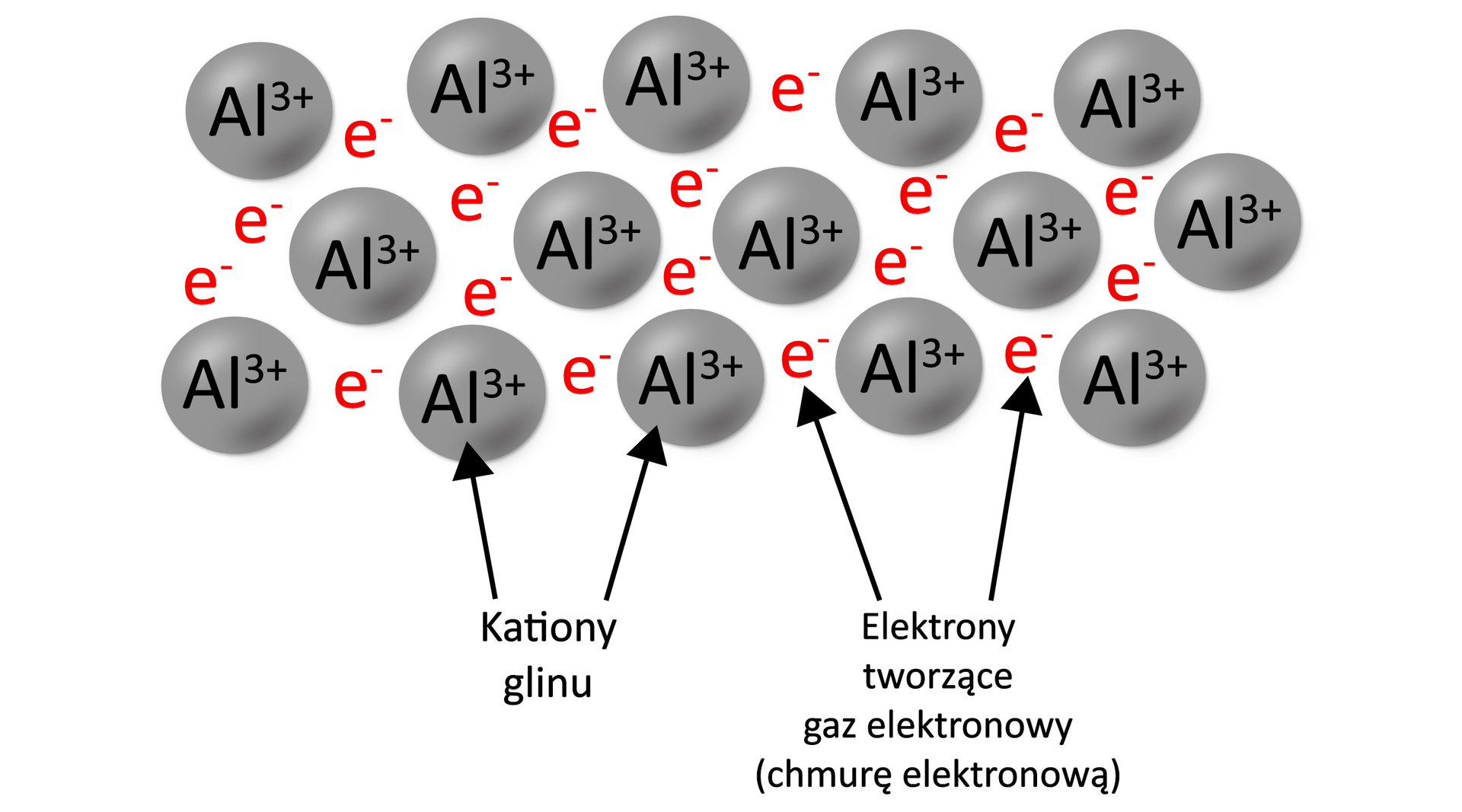
Glin znajduje liczne zastosowania, jednak jego mała wytrzymałość mechaniczna, wynikająca z ułożenia kationów w przestrzeni, ogranicza pełne jego wykorzystanie. Większe znaczenie mają stopystopy glinu, które wykazują większą twardość i wytrzymałość mechaniczną. Przykładem może być duraluminium (dural, skład: , , , , oraz ).

Podsumowanie
Choć glin został odkryty w I połowie XIX w., to wciąż znajduje liczne i różnorodne zastosowania. Właściwości fizyczne glinu są niezwykle cenne dla przemysłu, ponieważ dzięki niemu można tworzyć bardzo lekkie przedmioty. Poza tym glin dobrze przewodzi prąd elektryczny i ciepło. Jest bardzo ciągliwy i kowalny, dzięki czemu można go rozwalcowywać i produkować materiały dobrane do naszych potrzeb. Nie ma wątpliwości, że glin znajdzie również swoje miejsce w przyszłości, patrząc na to, jak stale wzrasta na niego zapotrzebowanie.
Słownik
mieszanina substancji, składająca się z dwóch lub więcej pierwiastków chemicznych, z których jeden występuje w przeważającej ilości i jest metalem
(gr. elektron „bursztyn”) ujemnie naładowana cząstka elementarna, występująca na ostatnich podpowłokach, tzw. walencyjnych wokół atomu
jądro atomu wraz ze wszystkimi elektronami, oprócz elektronów walencyjnych
wiązanie, które występuje w sieciach krystalicznych metali, stopach metali i związkach międzymetalicznych; polega na elektrostatycznym oddziaływaniu dodatnich rdzeni atomowych metali ze swobodnie poruszającymi się elektronami (gaz elektronowy); odpowiada za niektóre właściwości fizyczne metali
Bibliografia
Bárta M., Pierwiastki chemiczne wokół nas, Warszawa 2013.
Bielański A., Chemia ogólna i nieorganiczna, Warszawa 1977.
Buczek I., Chrzanowski M., Dymara J., Persona A., Kowalik E., Kuśmierczyk K., Odrowąż E., Sobczak M., Sygniewicz J., Chemia. Rozszerzenie. Repetytorium matura, Warszawa 2014.
Czerwiński A., Czerwińska A., Jelińska – Kazimierczuk M., Kuśmierczyk K., Chemia 1. Podręcznik dla liceum ogólnokształcącego, liceum profilowanego, technikum, Warszawa 2002.
Krzeczkowska M., Loch J., Mizera A., Chemia Repetytorium. Liceum – poziom podstawowy i rozszerzony, Warszawa–Bielsko‑Biała 2010.
Lautenschläger K. H., Schröter W., Wanninger A., Nowoczesne Kompendium Chemii, Warszawa 2007.
Litwin M., Styka – Wlazło S., Szymońska J., To jest chemia 1. Chemia ogólna i nieorganiczna. Podręcznik dla liceum ogólnokształcącego i technikum. Zakres rozszerzony, Warszawa 2018.
Pazdro K. M., Chemia. Pierwiastki i związki nieorganiczne, Warszawa 2012.