Przeczytaj
Bromowanie fenyloaminy
Fenyloamina (aminobenzen) o zwyczajowej nazwie anilina to najprostsza amina aromatycznaamina aromatyczna o wzorze:

Do jednego z atomów węgla pierścienia aromatycznego przyłączona jest grupa aminowa . Grupa ta jest grupą elektrodonorowągrupą elektrodonorową, czyli wzbogacającą pierścień aromatyczny w elektrony pochodzące z wolnej pary elektronowej atomu azotu. Dzięki temu grupa aminowa silnie aktywuje pierścień, czego skutkiem jest kierowanie podstawników w reakcjach substytucji elektrofilowejsubstytucji elektrofilowej w pozycje orto i para.

Wolna para elektronowa atomu azotu może przechodzić na pierścień, wskutek czego tworzą się trzy możliwe struktury (tzw. mezomerycznemezomeryczne) a nadmiarowy ładunek ujemny występuje w pozycjach orto i para, tak jak przedstawiono poniżej:

Substytucja elektrofilowa to typ reakcji chemicznej charakterystycznej dla węglowodorów aromatycznych oraz ich pochodnych. Polega na podstawieniu atomu wodoru „drobiną” o charakterze elektrofilowym (o ładunku dodatnim). Jest to możliwe dzięki oddziaływaniu chmury elektronowej pierścienia aromatycznego dostarczającej ładunek ujemny z daną „drobiną”. Jedną z reakcji substytucji elektrofilowej jest bromowanie, czyli reakcja z roztworem bromu.
Większość reakcji bromowania wymaga specjalnych warunków i przebiega z udziałem katalizatora (np. ), a w wyniku reakcji otrzymuje się monobromopochodne. Na przykład w wyniku bromowania toluenu (metylobenzenu) otrzymuje się mieszaninę składającą się z –bromotoluenu oraz –bromotoluenu. W przypadku bromowania aniliny stężonym roztworem bromu podstawienie następuje niemal od razu w trzech pozycjach (orto i para) i nie wymaga użycia katalizatora. Reakcja zachodzi już w temperaturze pokojowej, a jej produktem jest ,,–tribromofenyloamina (,,–tribromoanilin). Reakcję tę można zapisać w następujący sposób:
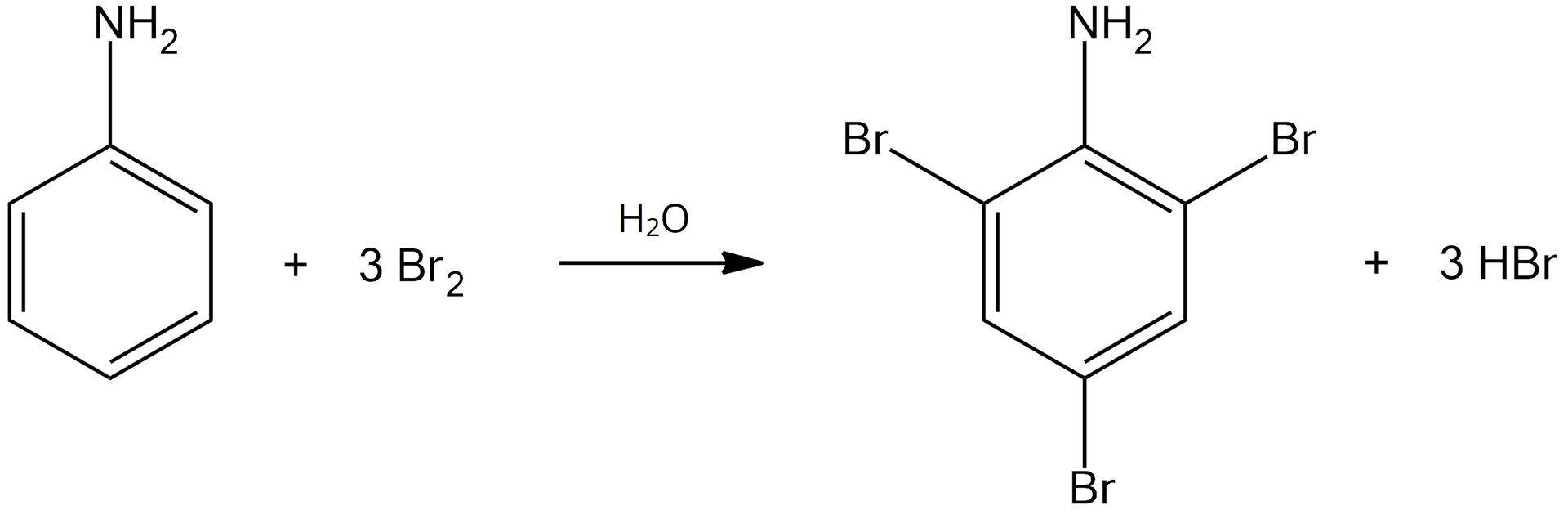
Podstawienie w trzech miejscach jest możliwe dzięki silnie aktywującej grupie aminowej. Reakcja wprowadzenia pierwszego podstawnika przebiega równie łatwo w pozycji orto i para.

Dzięki strukturom rezonansowymstrukturom rezonansowym aniliny i tworzącym się ładunkom ujemnym w pozycjach orto i para następuje ich oddziaływanie z cząsteczką bromu, w wyniku czego następuje jej częściowa polaryzacja i na jednym atomie tworzy się cząstkowy ładunek dodatni, a na drugim – cząstkowy ładunek ujemny. W ten sposób otrzymuje się odczynnik elektrofilowy w postaci kationu . Tworzą się wówczas struktury przejściowe, w których jednocześnie zrywane zostaje wiązanie z atomem wodoru a tworzone wiązanie z elektrofilemelektrofilem. Następuje odtworzenie układu elektronowego w benzenie – powstaje wówczas –bromoanilina lub –bromoanilina. Dalsza substytucja przebiega poprzez powtórzenie powyższych etapów. Mechanizm reakcji bromowania fenyloaminy można przedstawić następującym schematem:

Powstające monobromopochodne i dibromopochodne aniliny, łatwo ulegają dalszemu bromowaniu, a w każdym przypadku kierujący wpływ grupy aminowej dominuje nad wpływem bromu. Z tego powodu jedynym produktem tej reakcji jest ,,–tribromoanilina. Jeżeli natomiast do reakcji bromowania użyje się silnie rozcieńczonego roztworu bromu to monobromochodne nie ulegają dalszemu bromowaniu, a reakcję zapisuje się w następujący sposób:

W wyniku tej reakcji powstaje –bromofenyloamina (–bromoanilina) oraz –bromofenyloamina (–bromoanilina).
Słownik
związki organiczne, w których grupa aminowa przyłączona jest bezpośrednio do pierścienia aromatycznego
podstawniki, które „dostarczają” elektrony do pierścienia aromatycznego; wówczas podstawnik ulega sprzężeniu z pierścieniem aromatycznym
reakcja substytucji (podstawienia) zachodząca dla związków aromatycznych, w której czynnikiem atakującym jest elektrofil
struktury związków chemicznych i innych indywiduów chemicznych przedstawione za pomocą tzw. struktur granicznych; faktyczna struktura cząsteczki jest opisywana przez kombinację liniową tych struktur
indywiduum chemiczne obdarzone ładunkiem dodatnim (w reakcji bromowania jest to , w reakcji nitrowania , w reakcji chlorowania , w reakcji metylowania , itd.)
Bibliografia
Vogel, Preparatyka organiczna, wyd. II, Warszawa, 1984.
Morrison R. T., Boyd R. N., Chemia organiczna, Warszawa, PWN, 1985.
McMurry J., Chemia organiczna, Warszawa, PWN, 2000.
McMurry J., Chemia organiczna, Warszawa, PWN, 2016.
Danikiewicz W., Część III. Chemia organiczna, Warszawa, OE, 2009.
Kaznowski K., CHEMIA Vademecum maturalne, Warszawa, OE, 2016.