Przeczytaj
E‑materiały powiązane z tematem
Budowa i miejsce występowania różnych rodzajów nabłonków
Rodzaj nabłonka | Cechy budowy | Lokalizacja |
|---|---|---|
Nabłonek jednowarstwowy płaski  | – komórki spłaszczone; | błony surowicze (opłucna, osierdziowa, otrzewna), przedsionki komory serca, naczynia krwionośne i limfatyczne, ściany pęcherzyków płucnych, powłoki ciała bezkręgowców |
Nabłonek jednowarstwowy sześcienny 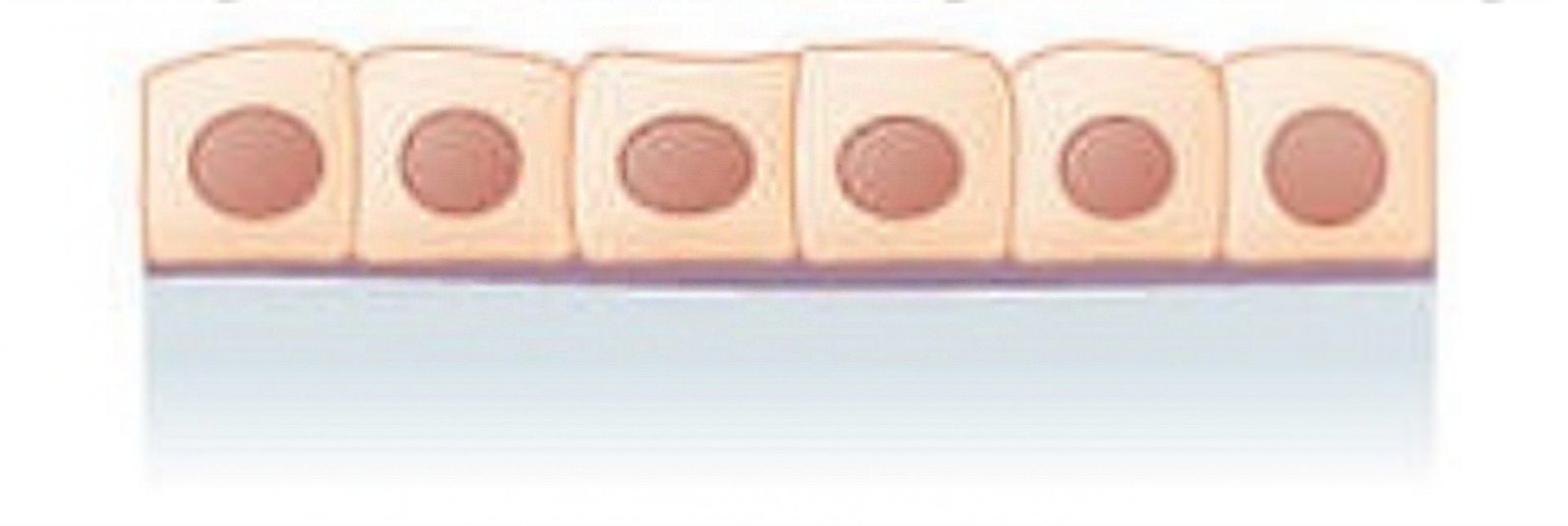 | – komórki w kształcie sześcianu | kanaliki nerkowe, oskrzeliki, powierzchnia jajnika, siatkówka, wyściółka przewodów wyprowadzających gruczołów wydzielania zewnętrznego |
Nabłonek jednowarstwowy walcowaty  | – komórki wysokie w kształcie walca | wyściółka jelit, jajowodów, pęcherzyka żółciowego i przewodów żółciowych, powłoki ciała bezkręgowców (np. pierścienic, mięczaków) |
Nabłonek jednowarstwowy wielorzędowy 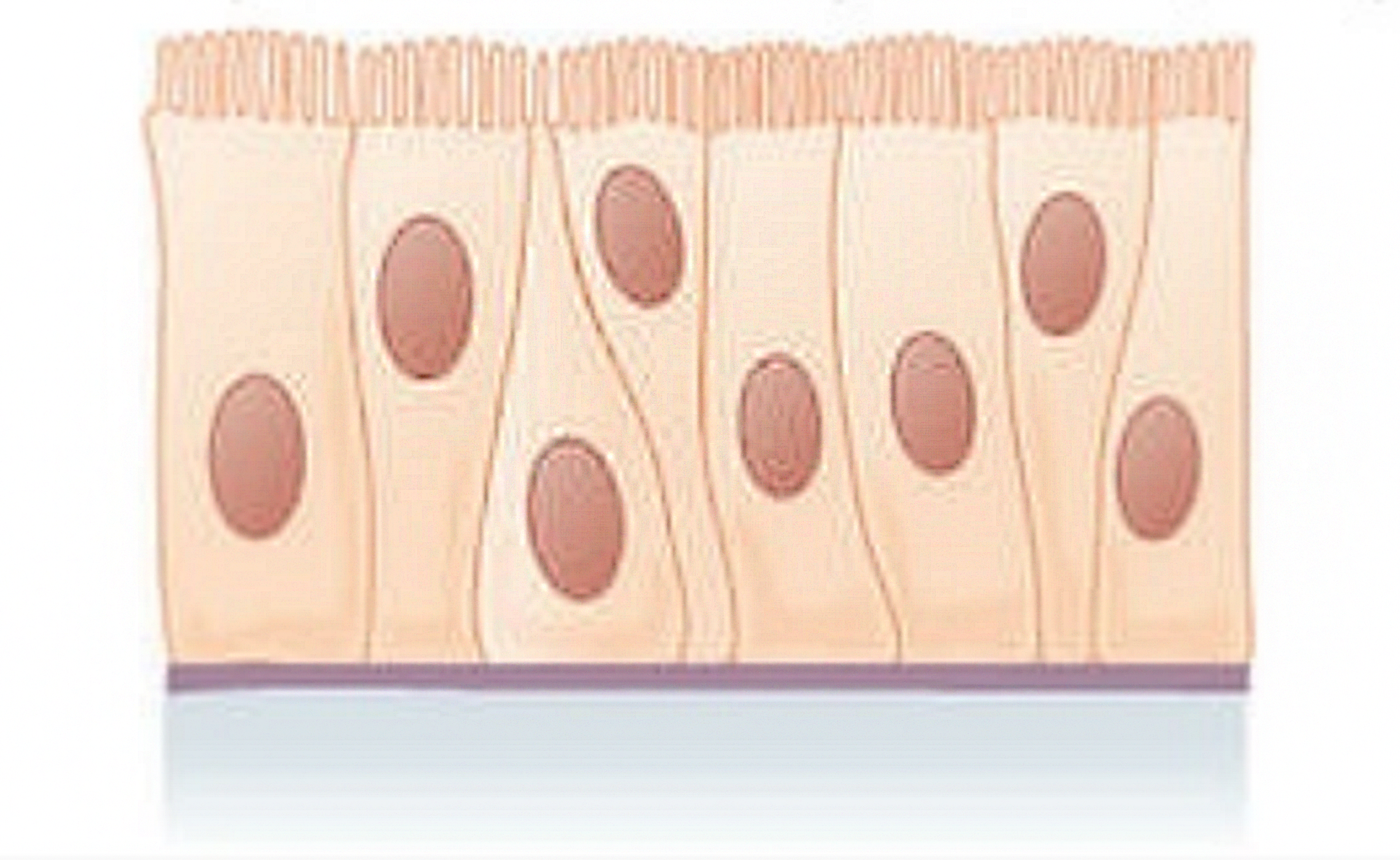 | – komórki dwóch rodzajów: wysokie w kształcie graniastosłupów oraz niskie, klinowate | wyściółka pęcherza moczowego, dróg oddechowych kręgowców lądowych, pochwa |
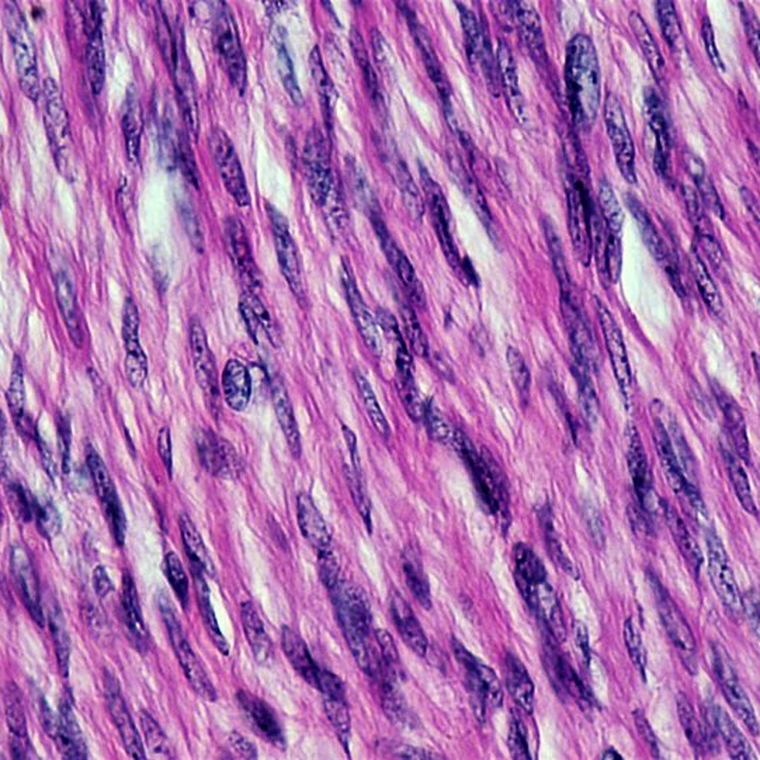
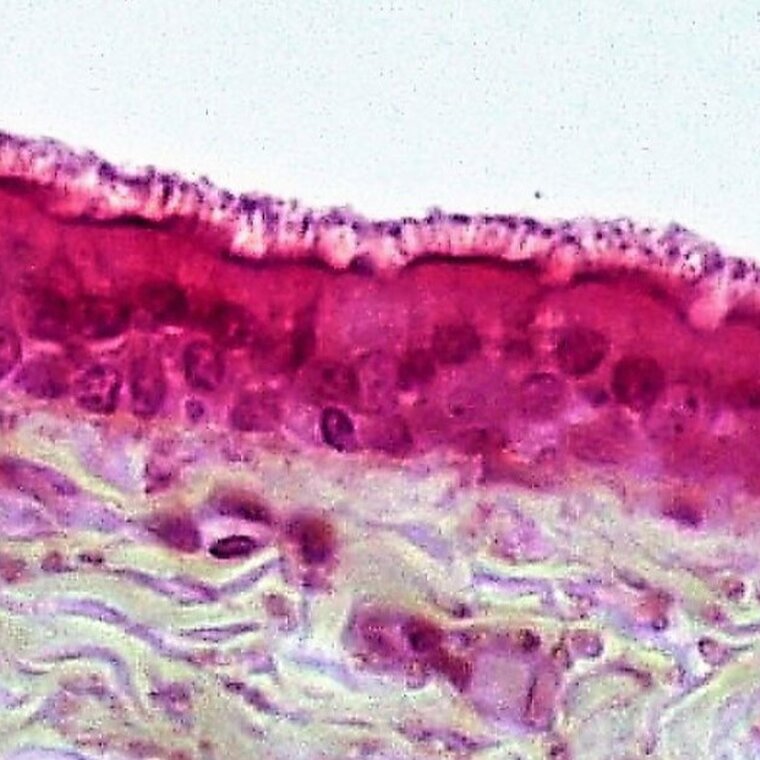
Nabłonek wielowarstwowy płaski  | – komórki ułożone w wielu warstwach spłaszczające się w miarę oddalania od błony podstawnej | powierzchnia ciała kręgowców, rogówka oka, jama gębowa, odbyt, pochwa |
Nabłonek wielowarstwowy sześcienny 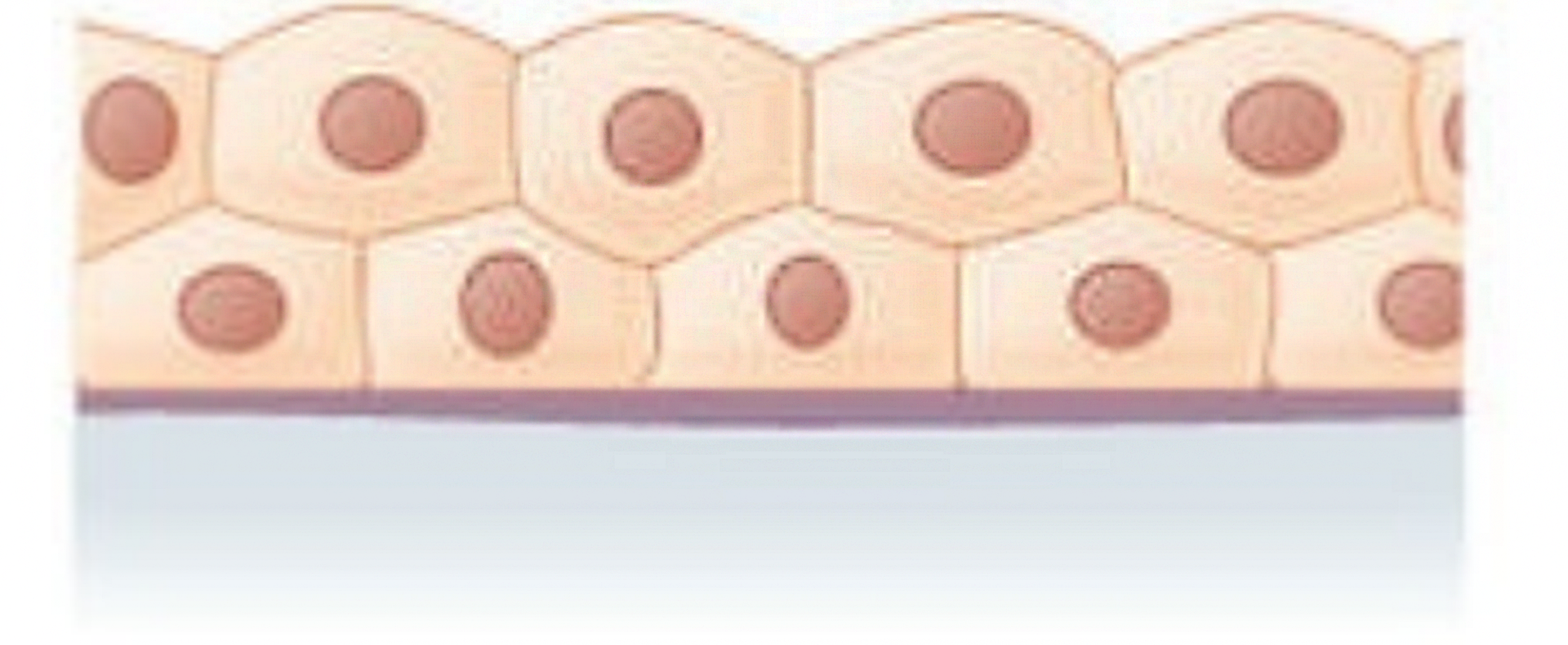 | – komórki ułożone w kilku warstwach, mające kształt sześcianu | ślinianki, gruczoły potowe, spojówka |
Nabłonek wielowarstwowy walcowaty 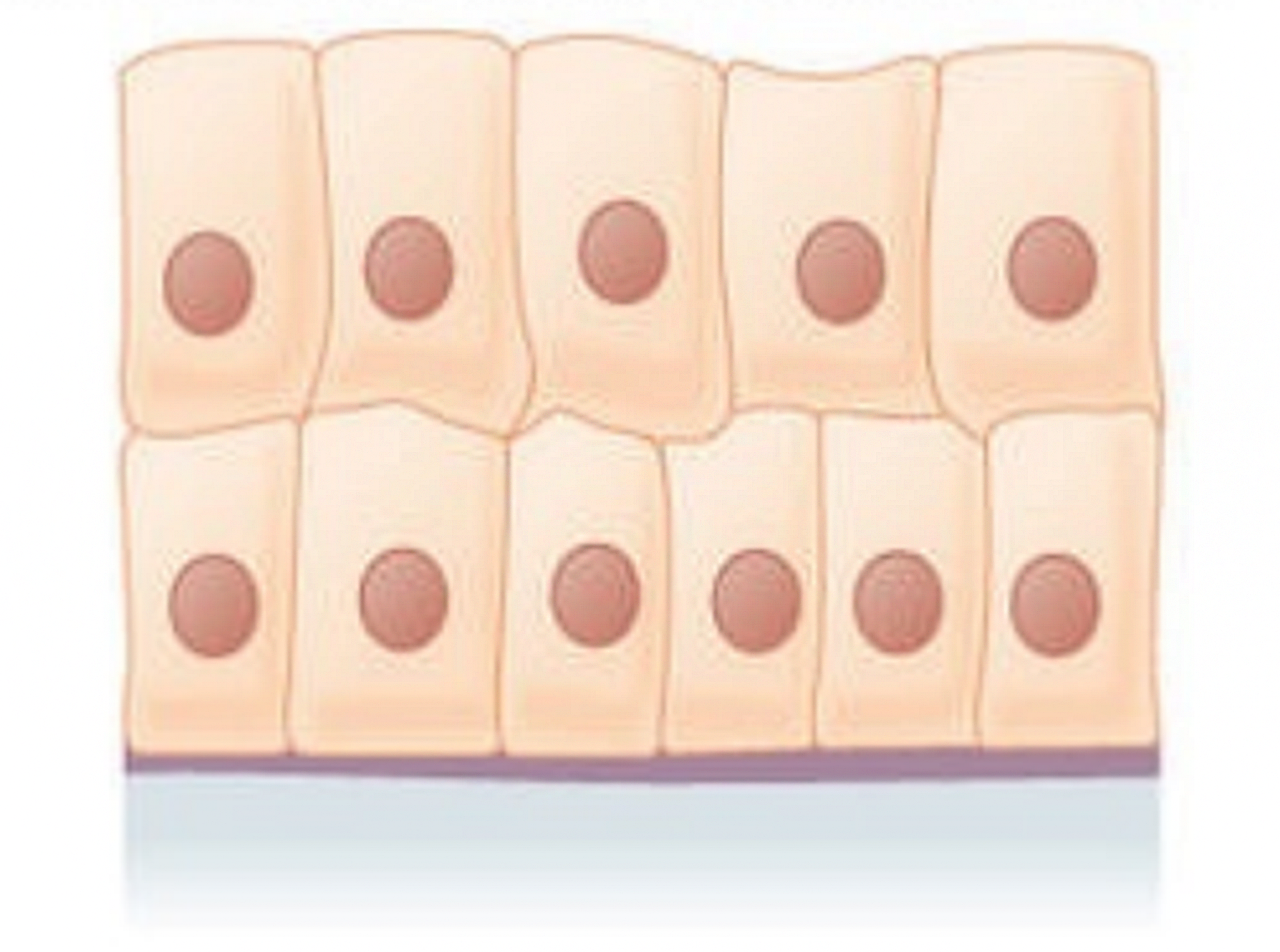 | – komórki ułożone w kilku warstwach, mające kształt walca | krtań, jama nosowa, powłoki ciała ryb |
Obserwacja mikroskopowa tkanek zwierzęcych
Do obserwacji struktur tkankowych i komórkowych używa się głównie mikroskopów (z gr. mikros – mały, skopeo – patrzę, obserwuję) – przyrządów optycznych pozwalających na otrzymywanie powiększonych obrazów obiektów niewidocznych gołym okiem.
Wynalezienie mikroskopu najczęściej przypisuje się dwóm Holendrom – Hansowi i Zachariaszowi Janssenom (ojcu i synowi) – którzy na przełomie XVI i XVII w. skonstruowali urządzenie składające się z dwóch soczewek zamocowanych na obu końcach rury. Przyrząd ten, zwany mikroskopem sprzężonym, pozwalał na zaledwie 10‑krotne powiększenie obserwowanego obiektu. Obserwacja komórek stała się możliwa nieco później – w połowie XVII w. – dzięki wynalezieniu mikroskopu optycznego (świetlnego) przez angielskiego przyrodnika i eksperymentatora Roberta Hooke’a (1635–1703).
Współcześnie najczęściej stosowanymi mikroskopami są: mikroskopy optyczne (świetlne), mikroskopy fluorescencyjne oraz mikroskopy elektronowe.
Więcej na temat mikroskopów i mechanizmów ich działania w e‑materiale Rodzaje mikroskopów używanych w badaniach biologicznychRodzaje mikroskopów używanych w badaniach biologicznych.
W obserwacji mikroskopowej komórki i ich elementy nie wykazują różnic w absorpcji promieniowania elektromagnetycznego, co przekłada się na brak wyraźnego kontrastu między poszczególnymi elementami. Nie ma więc możliwości rozróżnienia szczegółów budowy danej tkanki czy też elementów komórki. Z tego powodu w preparatach mikroskopowych niezbędne jest zastosowanie barwników histologicznych, które wybarwiają komórki wraz z ich elementami strukturalnymi, a tym samym umożliwiają ich dokładną obserwację i identyfikację.
Barwniki histologiczne
Barwniki histologiczne to związki chemiczne wykorzystywane w mikroskopii świetlnej do wybarwiania struktur komórkowych i tkankowych. Typowy barwnik zawiera dwie grupy chemiczne: chwytną i barwną. Część chwytna łączy się z elementami komórkowymi o określonym składzie chemicznym, natomiast barwna absorbuje światło o określonej długości fali, dzięki czemu możliwe jest dostrzeżenie wybarwionych struktur.
W zależności od struktury, jaką się będzie obserwować, należy zastosować odpowiedni barwnik histologiczny.
Poniżej przedstawiono przykładowe metody barwienia preparatów histologicznych.
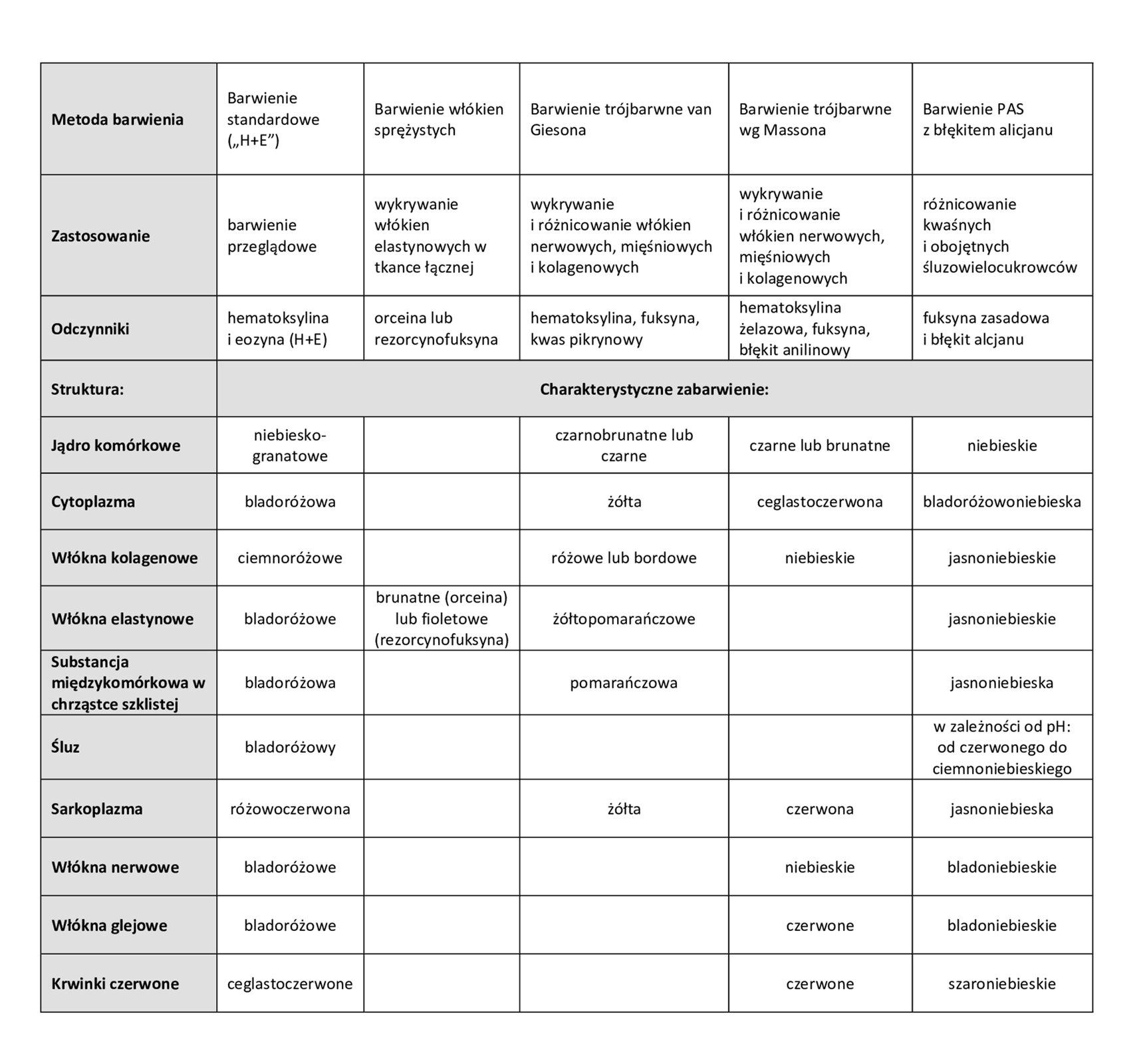
Hematoksylina i eozyna
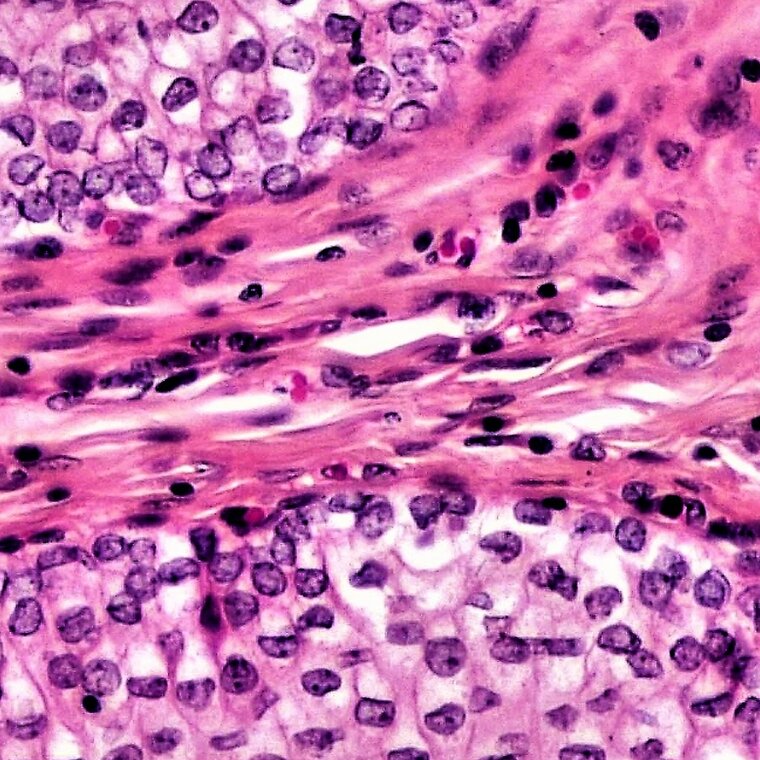
Najczęściej stosowanymi barwnikami w histologii są hematoksylinahematoksylina oraz eozynaeozyna (H+E).
Hematoksylina to niebieski barwnik, którym wykrywa się kwasowe (zasadochłonne) elementy komórki, takie jak jądro komórkowe czy siateczka śródplazmatyczna szorstka. Zazwyczaj stosowana jest w połączeniu z eozyną.
Eozyna to kwasowy barwnik o czerwonej barwie służący do wykrywania zasadowych (kwasochłonnych) struktur komórkowych, takich jak cytoplazma i włókna kolagenowe.
Przygotowanie preparatu mikroskopowego
Odparafinowanie i nawodnienie materiału
2 × 5 min w ksylenie (rozpuszcza parafinę)
2 × 3 min w etanolu 99,8%
1 × 3 min w etanolu 96%
1 × 3 min w etanolu 90%
1 × 3 min w etanolu 80%
1 × 3 min w etanolu 70%
1 × 3 min w etanolu 50%
1 × 3 min w etanolu 30%
1 × 3 min w dHIndeks dolny 22O
Barwienie hematoksyliną i eozyną
Zanurz skrawki na 3 minuty w wodzie destylowanej.
Umieść skrawki na 5 minut w roztworze hematoksylinyhematoksyliny.
Przebarwione skrawki odbarw przez 2–3 sekundy w zakwaszonym alkoholu (0,25 ml HCl na 100 ml alkoholu 70%).
Przepłucz skrawki pod bieżącą wodą i skontroluj ich jakość pod mikroskopem.
Zanurz skrawki na minutę w roztworze eozynyeozyny.
Przepłucz je wodą destylowaną.
Odwadnianie i zamykanie preparatów
1 × 5 min w etanolu 96%
2 × 5 min w etanolu 100%
2 × 10 min w ksylenie (wcześniej usuń nadmiar etanolu)
Zamknij preparat w kropli DPX (nie osuszaj preparatu z ksylenu).
Susz preparat w 37°C przez noc lub 2 godziny w 45°C.
Wyniki barwienia
Elementy zasadochłonne (np. jądra komórkowe) barwią się na niebiesko, a elementy kwasochłonne na czerwono.
Jądra komórkowe – chromatyna: niebieska
Cytoplazma: różowa
Tkanka łączna: szarofioletowa
Słownik
zespół metod mających na celu wizualizację określonych struktur, elementów komórkowych lub identyfikację związków chemicznych w materiale roślinnym lub zwierzęcym; barwienie preparatów mikroskopowych dokonuje się przez naniesienie barwnika (związku chemicznego) na szkiełko mikroskopowe
proces patologiczny, zmiana polegająca na uszkodzeniu narządu lub tkanki
bromowa pochodna fluoresceiny; wykazuje właściwości kwasowe i dlatego ma silniejsze powinowactwo do elementów komórki o charakterze kwasochłonnym; stosowana jest m.in. w metodzie barwienia Giemsy; elementy komórkowe zasadochłonne, w tym jądra komórkowe, wybarwiają się na kolor niebieski, a kwasochłonne na kolor czerwony
wartość stosowana do opisu zjawisk okresowych; określa stan ruchu w danej chwili
zjawisko polegające na emitowaniu fal świetlnych przez cząsteczkę fluorochromu wzbudzoną światłem o właściwej długości fali
rodzaj fotoluminescencjifotoluminescencji; zanika w stosunkowo długim czasie (w porównaniu z fluorescencjąfluorescencją)
luminescencja zachodząca w wyniku powrotu do stanu podstawowego cząsteczek lub atomów wzbudzonych do wyższych stanów elektronowych promieniowaniem elektromagnetycznym (zakresu widzialnego i nadfioletu)
pozyskiwana jest z drewna modrzejca kampechiańskiego (Erythroxylon campechianum); w jej składzie wyróżnić można roztwory soli żelaza, glinu, wolframu i chromu; dzięki jonom metalu elementy komórkowe chłoną barwnik, co uwidocznione jest na preparacie szkiełkowym; aby hematoksylina miała zdolność do wybarwiania jądra komórkowego, konieczny jest proces utleniania barwnika (co wykonuje się w warunkach laboratoryjnych za pomocą np. światła słonecznego lub substancji chemicznych)
zjawisko fizyczne nakładania się dwóch (lub więcej) fal, przy którym w różnych punktach przestrzeni następuje wzmacnianie lub osłabianie amplitudy fali wypadkowej
przyrząd do cięcia tkanek na cienkie skrawki, z których sporządza się preparaty mikroskopowe; skrawki mają grubość ok. 0,1–20 µm (do mikroskopów optycznych) lub 0,03–0,1 µm (do mikroskopów elektronowych)
obiekty biologiczne przygotowywane w specjalny sposób do analizy podczas obserwacji mikroskopowej; każdy rodzaj mikroskopu wymaga odmiennego sposobu wykonania preparatu
różnica pomiędzy wartościami fazyfazy dwóch fal, np. świetlnych
(z ang. periodic acid–Schiff) jedna z najczęściej wykorzystywanych metod chemicznych służących do wykrywania aldehydu i substancji śluzowych w badaniach histologicznych; odczynnik Schiffa może służyć do barwienia mukopolisacharydów w preparatach tkankowych
przezroczysta przednia część błony zewnętrznej oka kręgowców, właściwa także dla człowieka