Przeczytaj
Klasyfikacja układów materialnych, analizowanych w termodynamicetermodynamice w ujęciu makroskopowym, dzieli je na układyukłady heterogeniczne i homogeniczne. Podział ten wynika bezpośrednio z faktu, że ich elementy różnią się właściwościami fizycznymi (stan skupienia, rozpuszczalność, temperatura topnienia) lub nie. Na dany układ składają się wszystkie substancje biorące udział w procesie. Wyodrębniona część układu o takich samych właściwościach to fazafaza. Wyróżniamy trzy podstawowe rodzaje faz: ciało stałe, ciecz i gaz. Są one oddzielone od pozostałych części układu powierzchniami, zwanymi granicami faz. Mogą one przechodzić jedna w drugą w sposób samorzutny, jeżeli ∆S>0 lub ∆G<0 (∆S – entropiaentropia, ∆G – entalpia swobodnaentalpia swobodna). Występowanie różnych faz dla danego układu w pewnych zakresach temperatur i ciśnienia oraz ich wzajemnych przemian, można przedstawiać przy użyciu diagramu fazowego.
Diagram fazowy
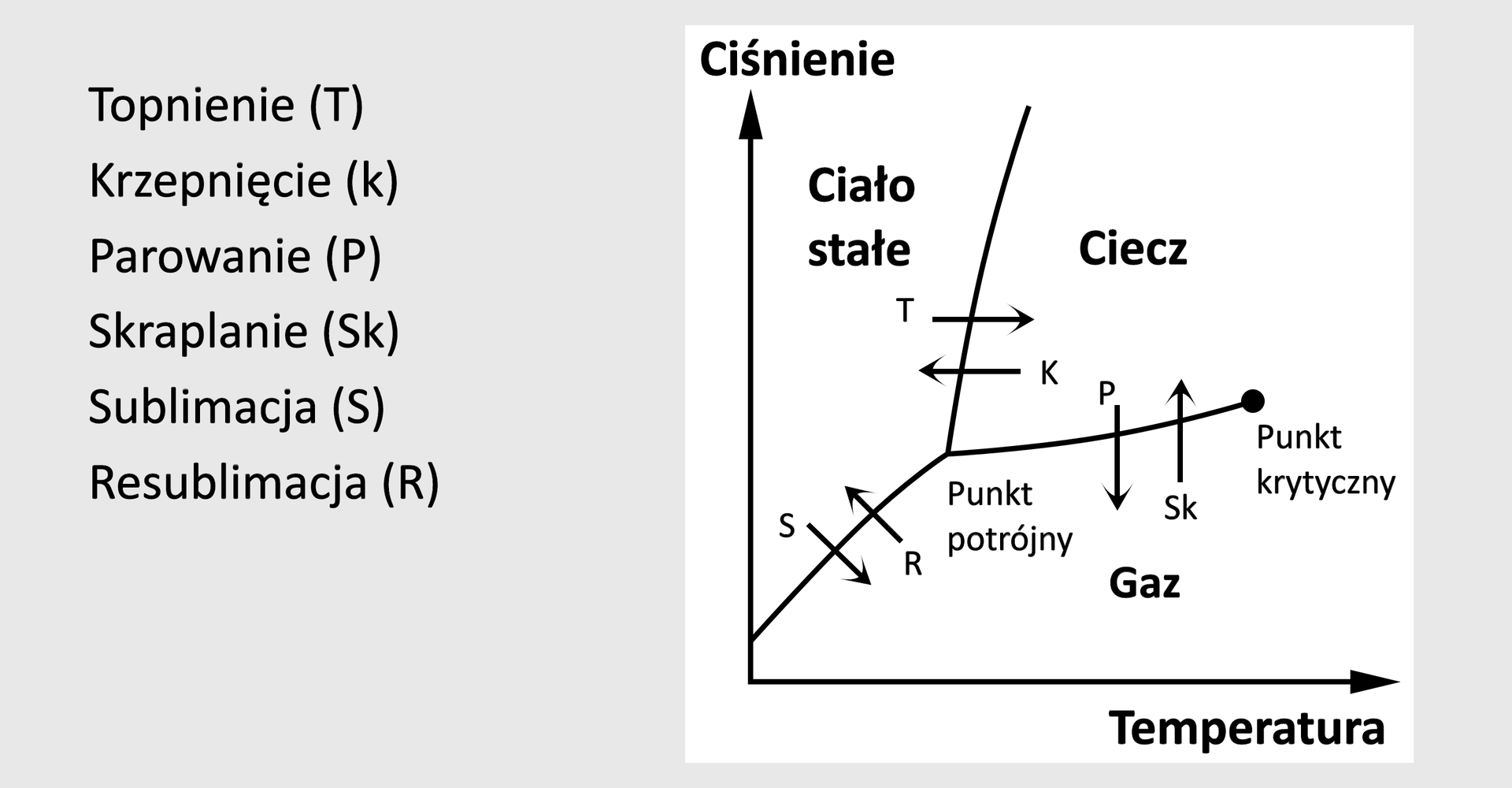
Taki diagram ilustruje zależność istnienia faz układu w zależności od ciśnienia i temperatury. Obecne na tym wykresie linie rozgraniczające opisują stany równowagi między odpowiednimi fazami, tj: ciało stałe‑gaz, ciało stałe‑ciecz, oraz gaz‑ciecz. Na wykresie występuje również punkt (punkt potrójny), który wskazuje warunki współistnienia trzech faz równocześnie. Ważne w tym aspekcie są również pojęcia ciśnienia krytycznego oraz temperatury krytycznej. Za ciśnienie krytyczne uważa się najwyższe ciśnienie, pod którym można przeprowadzić ciecz w gaz lub maksymalne ciśnienie pary nasyconej nad cieczą. Temperatura krytyczna to ta najwyższa, w której można skroplić gaz, powodując wzrost ciśnienia. Temperatura krytyczna i ciśnienie krytyczne opisują tzw. punkt krytyczny, w którym ciecz i gaz stają się nierozróżnialne.
Z powyższymi pojęciami związana jest reguła faz Gibbsa. Jest to zależność, która obowiązuje dla każdego układu występującego w równowadze termodynamicznej, łącząca liczbę faz (f) w układzie z liczbą składników niezależnych (n) oraz liczbą stopni swobody (s).
Liczba stopni swobody (s) to liczba niezależnych zmiennych intensywnych, którą można zmieniać, nie ingerując przy tym w liczby faz w równowadze układu izolowanego.
Składniki niezależne układu (liczba składników niezależnych – n) to najmniejsza liczba składników rozpatrywanego układu, niezbędna do zbudowania każdej fazy układu w dowolnej ilości. W przypadkach, kiedy między składnikami układu mogą zachodzić reakcje chemiczne, liczbę składników niezależnych układu oblicza się odejmując od ogólnej liczby składników (tj. ogólnej liczby substancji, z jakich składa się rozpatrywany układ) liczbę niezależnych równań reakcji chemicznych.
Oblicz, ile wynosi liczba składników niezależnych i stopni swobody dla poniższej reakcji:
Liczba składników dla powyższej reakcji to 3:
;
;
.
Mamy do czynienia z 1 równaniem.
Układ niezależnych równań reakcji chemicznych oznacza taki układ równań chemicznych, w którym żadne równanie nie może być otrzymane przez liniową kombinację równań pozostałych.
Zatem liczba składników niezależnych wynosi:
(liczba składników) (liczba równań niezależnych)
Liczba faz wynosi :
faza stała: , ;
faza gazowa: .
Zatem liczba stopni swobody to:
Przykłady układów hetero- i homogenicznych

Przykładem układu heterogenicznego jest granit – skała zbudowana z kwarcu, skalenia potasowego, plagioklazu oraz biotytu, ale przykładem może być również włoski dressing czy ciasteczka z kawałkami orzechów i czekolady.
Układem heterogenicznym nazywamy więc taki układ, który jest niejednorodny bądź też jest wielofazowy. Może zawierać równocześnie wiele faz stałych, ciekłych i jedną fazę gazową (ponieważ gazy w sposób idealny ulegają wymieszaniu). W przypadku granitu możemy zaobserwować kilka faz stałych, które stanowią kwarc, skaleń potasowy, plagioklaz czy biotyt. Ciasteczka również zawierają kilka faz stałych, m.in. czekolada, orzechy i ciasto, z którego wykonane jest ciasteczko. Włoski dressing składa się z fazy ciekłej, którą stanowi oliwa z oliwek, i z wielu faz stałych, jakimi są przyprawy.

Przykładami układu homogenicznego są: wodny roztwór soli kuchennej, benzyna, powietrze, syrop klonowy oraz izotonik. Układem homogenicznym nazywamy zatem taki układ, który jest jednorodny bądź także jednofazowy.
Każdy układ składa się z substancji chemicznych, które nazywane są składnikami układu. Jeśli w danym układzie pojedyncza faza zawiera tylko jeden składnik, mówi się, że zawiera ona substancję czystą. Inna sytuacja ma miejsce wtedy, gdy dana faza posiada więcej składników. Wówczas nazywana jest roztworem. Ze względu na to, że faza może być cieczą, ciałem stałym lub gazem, wyróżnia się roztwory ciekłe, stałe lub gazowe.
Przemiany w układach
W układach mogą zachodzić dwa typy przemian:
przemiany fazowe;
przemiany chemiczne (reakcje chemiczne).
Przemiany fazowe to takie przemiany, w wyniku których nie obserwuje się zanikania obecnych ani powstawania nowych substancji chemicznych. Mogą jednak następować zmiany stanów skupienia oraz struktury (jedna faza może znikać kosztem pojawienia się nowej fazy). Do takich przemian należą np. sublimacjasublimacja, parowanie oraz przemiany polimorficzne, np. siarki rombowej w jednoskośną.
Przemiany chemiczne, czyli inaczej ujmując reakcje, to przemiany, w wyniku których znikają obecne w układzie substancje, a pojawiają się nowe. Przemiany tego typu mogą przebiegać między substancjami znajdującymi się w jednej fazie (np. hydroliza) lub też w kilku fazach (rekcja spalania).
Zarówno przemiany fazowe, jak i przemiany chemiczne są związane z określonymi efektami cieplnymi. Przykładowo – parowanie związane jest z pochłanianiem ciepła, podobnie jak endotermiczna reakcja termicznego rozkładu węglanu wapnia. Z oddawaniem ciepła mamy do czynienia w trakcie krzepnięcia wody oraz podczas reakcji magnezu z kwasem solnym.
Podaj przykład układu heterogenicznego, składającego się z jednego składnika.
Podaj przykład stałego układu homogenicznego.
Czy układ może mieć wiele składników i być układem jednorodnym homogenicznym? Jeśli tak, podaj przykład.
Słownik
dział fizyki badający efekty energetyczne przemian fizycznych i chemicznych; bada m.in. możliwość przebiegu danego procesu w określonych warunkach
forma występowania materii, która jest jednolita w całej swojej objętości pod względem składu chemicznego i właściwości fizycznych, oddzielona od pozostałych części układu wyraźnymi granicami
wszystkie substancje biorące udział w danej reakcji chemicznej
układ reakcyjny, który może wymieniać z otoczeniem materię i energię
układ, który nie wymienia z otoczeniem materii chemicznej, lecz może wymieniać z otoczeniem energię
układ, który nie może i nie wymienia z otoczeniem ani materii, ani energii
wszystkie elementy zewnętrzne, które nie biorą udziału w reakcji, czyli nie należą do układu
funkcja Gibbsa, informująca o samorzutności danej reakcji chemicznej lub procesu fizycznego
(gr. en + trepein „zmieniać”) termodynamiczna funkcja stanu, która określa kierunek przebiegu procesów samorzutnych w danym układzie; miara nieuporządkowania układu i rozproszenia energii
(łac. sublimare „wznosić, wywyższać”) przemiana fazowa bezpośredniego przejścia ze stanu stałego w stan gazowy z pominięciem stanu ciekłego
proces odwrotny do sublimacji; przemiana fazowa, polegająca na bezpośrednim przejściu substancji z fazy gazowej w fazę stałą, z pominięciem stanu ciekłego
Bibliografia
Bielański A., Podstawy chemii nieorganicznej, Warszawa 1994.
Encyklopedia PWN
Hejwowska S., Marcinkowski R., Równowagi i procesy jonowe, Gdynia 2005.



