Przeczytaj
Termochemia
Nauka badająca efekty cieplne reakcji chemicznych to termochemia. Należy ona do szerszego działu termodynamiki, który bada, czy dany proces jest w stanie przebiegać w określonych warunkach. Reakcje chemiczne mogą zachodzić z pochłonięciem lub wydzieleniem ciepła. Taka zmiana energii określana jest zazwyczaj (w warunkach stałego ciśnienia i temperatury) entalpią reakcjientalpią reakcji i opisywana jako . Jeśli dana reakcja jest reakcją egzotermicznąreakcją egzotermiczną, to znaczy, że w wyniku jej przebiegu z układu reakcyjnego wydzielane jest ciepło, zmiana entalpii przyjmuje zatem wartość ujemną (). Jeśli natomiast jest reakcją endotermicznąreakcją endotermiczną, czyli przebiega z pochłonięciem ciepła, zmiana entalpii będzie przyjmować wartość dodatnią ().
Pamiętaj, że entalpia reakcji odwrotnej jest, co do wielkości, taka sama, ale posiada przeciwny znak.
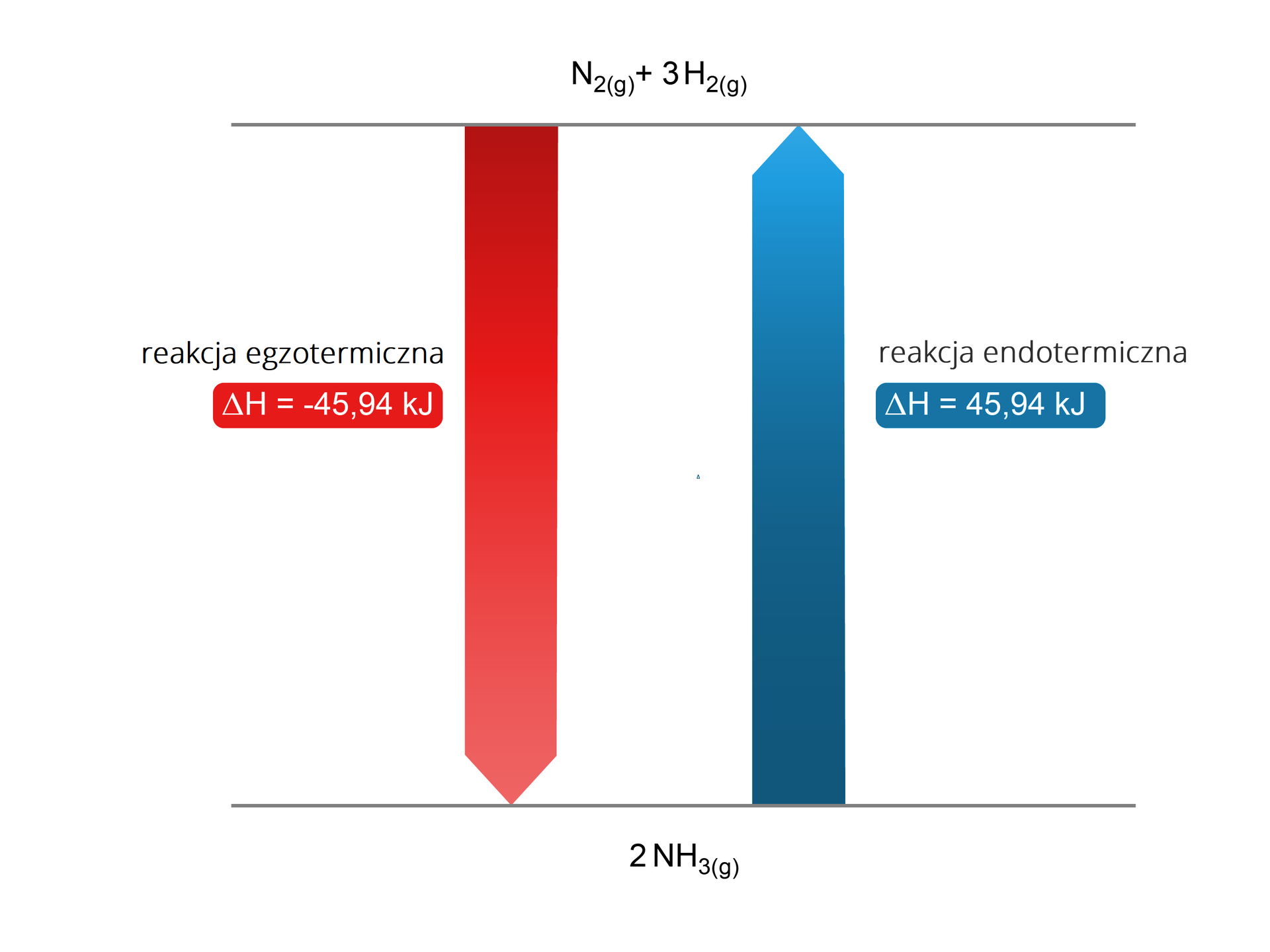
W poniższych harmoniach znajdziesz przykłady wcześniej wspomnianych reakcji egzo- i endotermicznych.
Przykłady procesów endotermicznych
Przykłady procesów egzotermicznych
Spójrz na ilustrację poniżej, aby lepiej zrozumieć i zapamiętać różnice pomiędzy reakcją egzo- i endotermiczną.
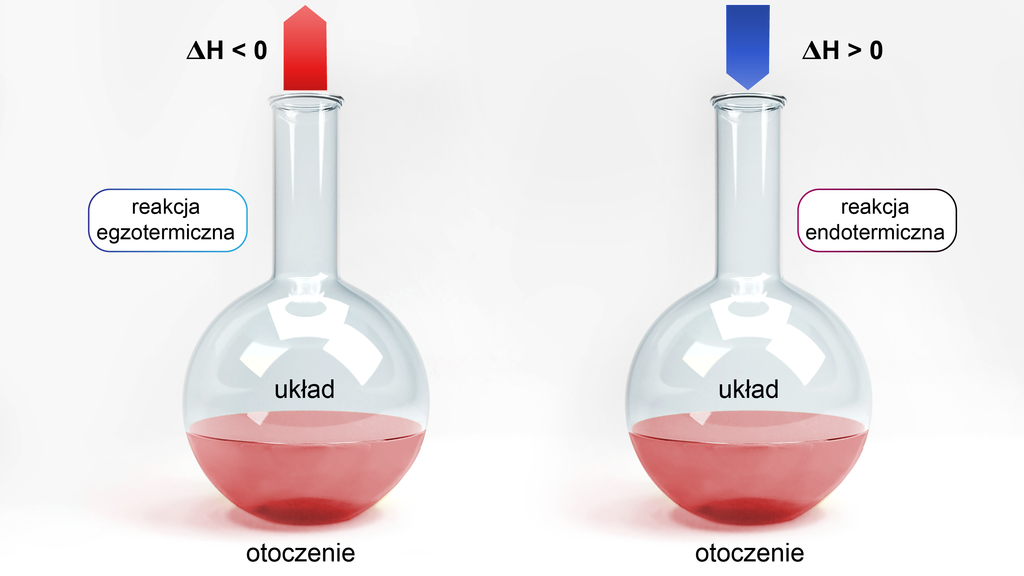
Układ a otoczenie
Badając aspekty związane ze zmianą ciepła reakcji, należy znać pojęcia, takie jak układukład oraz otoczenieotoczenie. Pierwsze z nich oznacza reagenty biorące udział w danej reakcji chemicznej (substraty oraz produkty), a na otoczenie składają się wszystkie elementy zewnętrzne, które nie biorą udziału w danej reakcji chemicznej (np. laboratorium, zlewka reakcyjna, naukowiec itp.). Wyróżnia się trzy typy układów:
układ otwartyukład otwarty – czyli taki, który może wymieniać z otoczeniem energię, jak i materię (np. z otoczenia pobierany jest tlen, a oddawana jest para wodna);
układ zamkniętyukład zamknięty – czyli taki, który nie wymienia z otoczeniem materii chemicznej, lecz może wymieniać z otoczeniem energię;
układ izolowanyukład izolowany – czyli taki, który nie może i nie wymienia z otoczeniem ani materii, ani energii.
Ciepło każdej reakcji chemicznej jest inne i zależy od stanu skupienia, w jakim znajdują się reagenty. Inne jego wartości będą obserwowane w przypadku zastosowania substratów gazowych, a inne dla stałych lub ciekłych. Dlatego w zapisie równań reakcji należy umieszczać właściwe oznaczenia stanów skupienia reagentów kolejno dla gazów (g), cieczy (c) i ciał stałych (s). Ciepło jest to ilość energii, którą można wyrazić np. w dżulach lub kaloriach.
Zmiana entalpii nie zawsze jest podawana w odniesieniu do 1 mola reagentu – może, ale nie musi. Jeśli w reakcji wszystkie współczynniki wynoszą więcej niż jeden i zapiszemy przy niej deltaH, to może ono się odnosić do zapisu reakcji lub być przeliczone na 1 mol reagentu.
Przykład
Oblicz zmianę entalpii reakcji rozkładu amoniaku w przeliczeniu na mol amoniaku, wiedząc, że rozkład amoniaku jest związany z pochłonięciem ciepła.
Należy napisać i uzgodnić równanie reakcjirównanie reakcji chemicznej:
Układamy proporcję na podstawie danych:
to ;
mol ma masę .
Podanie wartości przy uwzględnieniu, czy jest to reakcja endo-, czy egzotermiczna. Reakcja przebiega z pochłonięciem ciepła, więc .
Zatem .
Słownik
ciepło pochłaniane lub wydzielane w czasie reakcji chemicznej, które zostało zmierzone w stałych warunkach ciśnienia i temperatury w stosunku do reagentów
wszystkie substancje biorące udział w danej reakcji chemicznej
układ reakcyjny, który może wymieniać z otoczeniem materię i energię
układ, który nie wymienia z otoczeniem materii chemicznej, lecz może wymieniać z z nim energię
układ, który nie może i nie wymienia z otoczeniem ani materii, ani energii
wszystkie elementy zewnętrzne nie biorące udziału w reakcji, czyli nie należące do układu
reakcja chemiczna, która przebiega z wydzieleniem energii z układu reakcyjnego do otoczenia
reakcja chemiczna, która przebiega z pochłanianiem energii z otoczenia do układu reakcyjnego
zapis przebiegu reakcji chemicznej, uwzględniający stechiometryczne ilości substratów i produktów reakcji (ilość odpowiednich pierwiastków po lewej stronie jest równa tej po prawej stronie)
Bibliografia
Bielański A., Podstawy chemii nieorganicznej, Warszawa 1994.
Encyklopedia PWN
Hejwowska S., Marcinkowski R., Równowagi i procesy jonowe, Gdynia 2005.