Przeczytaj
Budowa odmian alotropowych węgla
AlotropiaAlotropia to zjawisko polegające na występowaniu różnych odmian tego samego pierwiastka, różniących się między sobą strukturą krystaliczną. Wszystkie odmiany składają się wyłącznie z atomów jednego pierwiastka, a zatem wszelkie różnice fizyczne i chemiczne muszą wynikać z połączeń atomów w strukturach.
W przypadku węgla w różnych jego odmianach alotropowych atomy wiążą się ze sobą na różne sposoby. Odmianami alotropowymi węgla są: grafit, diament, grafen, nanorurki węglowe oraz fullereny.
Grafit posiada strukturę zbudowaną z dwuwymiarowej jednostki heksagonalnej, w której każdy atom węgla jest połączony z trzema innymi atomami węgla wiązaniami kowalencyjnymi w tej samej warstwie. Między sobą warstwy układają się równolegle i związane są przez słabe siły Van der Waalsa. Dlatego grafit jest bardzo miękką odmianą węgla i potrafi pozostawić smugę na papierze.
W diamentach wszystkie atomy węgla w strukturze, o regularnej sieci przestrzennej o kształcie czworościanu foremnego (tetraedru), są połączone z czterema innymi atomami węgla za pomocą wiązań kowalencyjnych. Równomiernie rozłożone, krótkie i mocne wiązania kowalencyjne wpływają na bardzo dużą twardość, dlatego diament jest najtwardszą odmianą alotropową węgla.
Grafen jest to pojedyncza warstwa grafitu o hybrydyzacji orbitali walencyjnych atomów węgla . Jest to pierwszy materiał dwuwymiarowy jaki odkryto oraz jest to jeden z najtrwalszych materiałów na świecie (wytrzymałość na rozciąganie – gigapaskali).
Fullereny to jednowarstwowe cząsteczki o strukturze przypominającej kształt kuli, zbudowane z od do atomów węgla. Nanorurki węglowe to cylindryczne cząsteczki składające się ze zwiniętych arkuszy jednowarstwowych atomów węgla (grafenu), których orbitalom walencyjnym przypisujemy hybrydyzację .
Różnice w budowie wewnętrznej poszczególnych odmian alotropowych węgla skutkują zróżnicowanymi właściwościami tych odmian – m.in. właściwościami elektrycznymi, termicznymi oraz fizycznymi.
Nazwa | Grafit | Diament | Grafen | Fullereny | Nanorurki węglowe |
|---|---|---|---|---|---|
Struktura | 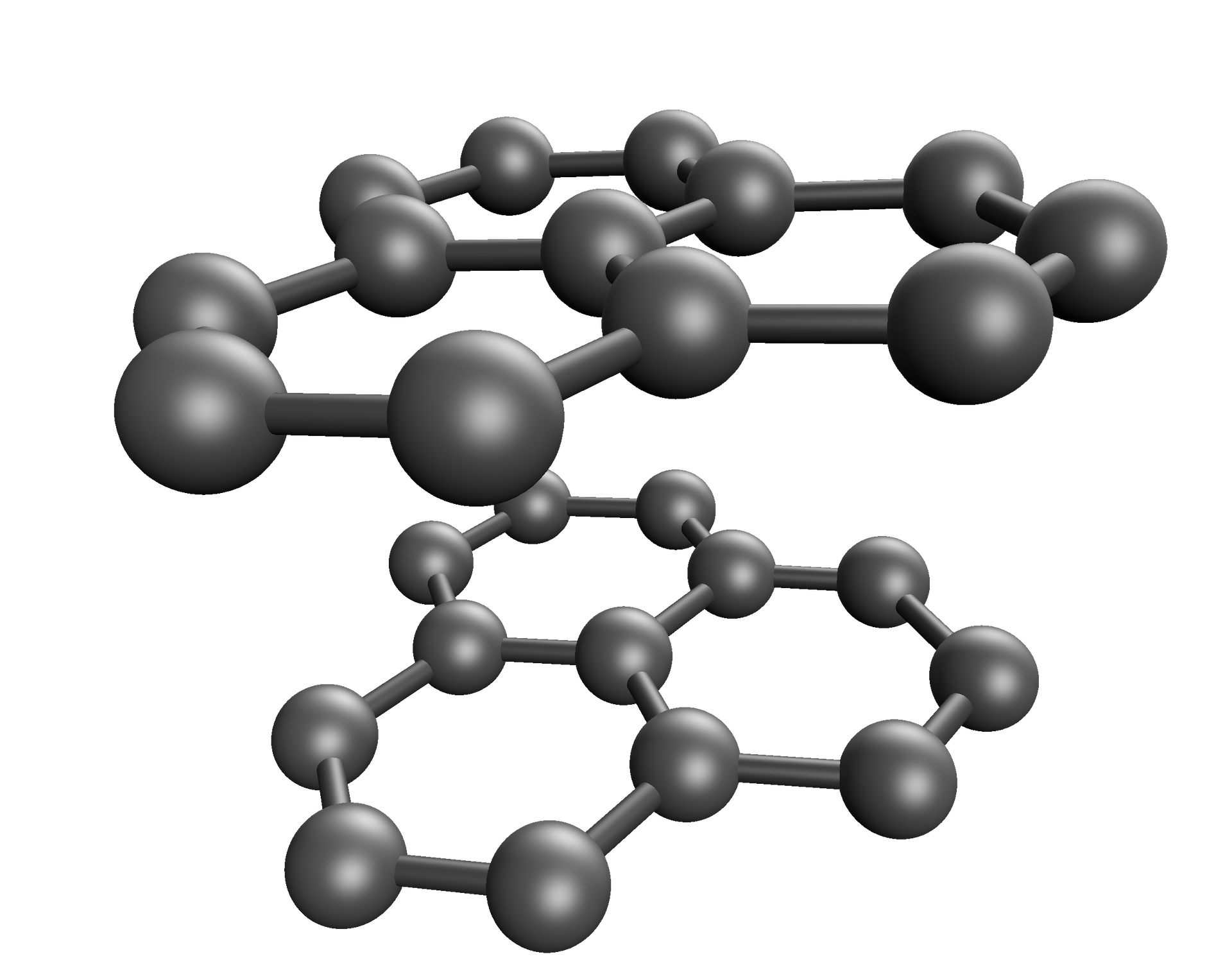 Źródło: GroMar Sp. z o.o., licencja: CC BY-SA 3.0. |  Źródło: GroMar Sp. z o.o., licencja: CC BY 3.0. |  Źródło: GroMar Sp. z o.o., licencja: CC BY-SA 3.0. |  Źródło: GroMar Sp. z o.o., licencja: CC BY-SA 3.0. |  Źródło: GroMar Sp. z o.o., licencja: CC BY-SA 3.0. |
Przewodność elektrycznaPrzewodność elektryczna | tak | nie | tak | nie | tak |
Przewodność cieplnaPrzewodność cieplna | stosunkowo niska | wysoka | wysoka | wysoka | wysoka |
Typ hybrydyzacji orbitali walencyjnych atomów węgla | i | ||||
Wygląd | ciemnoszary z metalicznym połyskiem | bezbarwny lub barwny (zanieczyszczony) | bezbarwny | czarne ciało stałe | czarne ciało stałe |
Właściwości | nierozpuszczalny w wodzie i miękki | nierozpuszczalny w wodzie, kruchy | elastyczny | nierozpuszczalne w wodzie, rozpuszczalne w niektórych niepolarnych rozpuszczalnikach np. w benzenie | nierozpuszczalne w wodzie i rozpuszczalnikach organicznych, elastyczne i sprężyste |
Zastosowanie | wkład do ołówków, smar i materiał ogniotrwały | w jubilerstwie, półprzewodnikach i jako narzędzie do cięcia | elektronika, półprzewodniki i filtracja wody | w fotooptyce i w elektronice, nośniki leków | w produkcji sprzętu sportowego, |
Diament

Diament to minerał, naturalnie występujący w postaci przezroczystych (mogą mieć kolory w zależności od zanieczyszczeń), silnie załamujących światło kryształów, które charakteryzują się bardzo dużą twardością. Ma on dobre właściwości optyczne – przepuszcza promieniowanie od podczerwieni do nadfioletu. Na jego twardość ma wpływ wysoka energia wiązań , która wynosi . Ponadto diament ma właściwości izolatora elektrycznego. Jest bardzo dobrym przewodnikiem ciepła, odpornym na działanie stężonych zasad i nieutleniających kwasów. Diament ulega spaleniu w temperaturze wyższej od . Te właściwości czynią go niezwykle ważnym i drogim surowcem w wielu branżach.
Grafit

Grafit ma strukturę zbudowaną z regularnych sześciokątów o wspólnych bokach. Atomy węgla w strukturze grafitu połączone są silnymi wiązaniami kowalencyjnymi w obrębie każdej warstwy z trzema sąsiednimi atomami tego pierwiastka, natomiast słabe siły van der Waalsa pomiędzy jego warstwami ułatwiają poślizg w płaszczyznach. Grafit charakteryzuje się wysoką przewodnością elektryczną (dzięki zdelokalizowanym elektronom) i cieplną, większą niż żelazo i stal, lecz mniejszą niż miedź i aluminium. Dzięki temu zyskuje zastosowanie jako element uszczelniający czy ślizgowy (służący do ruchomego połączenia elementów). Ma on niską reaktywność, jest ogniotrwały (topi się w temperaturze około ) i odporny chemicznie (jest odporny na działanie wielu kwasów i zasad).
Fullereny
Fullereny to cząsteczki zbudowane z parzystej liczby atomów węgla (od do około atomów węgla). Mają one metaliczny połysk, własności nadprzewodzącenadprzewodzące i półprzewodnikowe. Pod względem chemicznym mają właściwości zbliżone do sprzężonych węglowodorów aromatycznych, ponieważ składają się z układu sprzężonych pierścieni o pięciu i sześciu atomach węgla.
Zostały odkryte w roku przez Roberta Curla, Richarda Smalleya oraz Harolda Kroto. Eksperyment prowadzący do odkrycia kolejnej odmiany alotropowej węgla polegał na zastosowaniu laserowego naddźwiękowego generatora klastrów.

Promień laseralasera kierowany był na wolno obracającą się tarczę grafitową w obecności helu. Następnie węgiel w postaci gazowej kierowany był na spektrometr masowy (urządzenie pozwalające analizować masy jonów), który pozwalał zarejestrować masę nowo powstałych cząsteczek fullerenów.
Kolejne lata dostarczyły wielu innych technik syntezy fullerenów jednak najbardziej standardową metodą ich otrzymywania jest metoda płomieniowa. Polega ona na spalaniu acetylenu lub benzenu w tlenie. Wydajność tej metody jest niska () jednak ma istotne zalety jak ciągłość procesu, łatwość kontroli oraz możliwość zwiększenia skali produkcji.
Fullereny i nanorurki węglowe to jedyny przykład czystej węglowej odmiany alotropowej węgla, ponieważ wiązania brzegowe w diamencie i graficie są „wysycone” innymi pierwiastkami.
Nanorurki
Nanorurki węglowe to szczególny przykład izomerówizomerów fullerenów, mający doskonałe właściwości mechaniczne i elektryczne. Są to bardzo sprężyste i elastyczne materiały (moduł Youngamoduł Younga ), mają dobrą wytrzymałość przy rozciąganiu oraz zginaniu. Co ciekawe mają –krotnie większą wytrzymałość na rozciąganie od stali i razy większą gęstość prądu od miedzi. Są odporne na działanie wysokiej temperatury sięgającej nawet do .
Nanorurki otrzymuje się na skutek powolnej kondensacji gorących par atomów węgla. Struktura zamknięta nanorurek powstaje na skutek łączenia się niestabilnych, płaskich warstw węglowych (na brzegach płaskich płaszczyzn występują nienasycone wiązania o wysokiej energii).
Ze względu na swoje właściwości chemiczne, mechaniczne i elektryczne nanorurki znajdują zastosowanie w różnych gałęziach gospodarki jako bioczujniki, tranzystory, akumulatory litowo‑jonowe oraz materiały magazynujące wodór.
Grafen

Grafen to przezroczysty materiał i dobry przewodnik prądu. Elektrony poruszają się w nim razy szybciej niż w krzemie. Jest również dobrym przewodnikiem ciepła i bardzo wytrzymałym materiałem ( razy bardziej wytrzymały od stali).
Grafen można otrzymać w wyniku metody taśmy klejącej. Metoda ta polega na odrywaniu kolejnych warstw grafenu od grafitu, do momentu uzyskania pojedynczej warstwy grafenu. Obecnie do otrzymywania grafenu stosowana jest metoda osadzania chemicznego z fazy gazowej. Jest to metoda obróbki cieplno–chemicznej materiałów, która pozwala na nanoszenie cienkich powłok materiału.
Badania odmian alotropowych węgla
Jakość i czystość alotropów węgla można badać przy użyciu spektroskopii ramanowskiej. Jest to technika spektroskopowa, polegająca na pomiarze promieniowania nieelastycznego rozpraszania fotonówfotonów. Zastosowanie jej i analiza otrzymanych pasm na widmie, pozwala sprawdzić np. czy grafen jest zanieczyszczony lub czy występują w nim nieuporządkowania sieci krystalicznej, które mogą mieć istotny wpływ na uzyskanie przerwy energetycznej w jego strukturze.
Właściwości wynikające ze specyficznej budowy związków można badać i obserwować poprzez wykorzystanie transmisyjnego mikroskopu elektronowego (TEM).

Inną znaną metodą pozwalającą potwierdzić identyfikację fullerenów w materiale doświadczalnym jest spektroskopia magnetycznego rezonansu jądrowego (NMR). Jest to metoda, która wyczuwa zmiany struktury elektronowej wokół jądra atomowego i obecność innych jąder, dlatego NMR jest bardzo ważnym narzędziem analizy strukturalnej. Widma węglowe otrzymane w wyniku tej metody pozwalają potwierdzić symetryczną i złożoną budowę tych form alotropowych węgla.
Słownik
(gr. állos „obcy”, „inny”, trópos „sposób”, „postać”) – zjawisko występowania tego samego pierwiastka chemicznego w dwóch lub więcej odmianach, znajdujących się w tym samym stanie skupienia, różniących się budową wewnętrzną (sposobem połączenia atomów lub ich liczbą)
to proces polegający na przepływie ciepła i tym samym na przekazywaniu energii kinetycznej bezładnego ruchu cząsteczek ośrodka, z części układu o wyższej temperaturze do cząsteczek z części układu o temperaturze niższej
zjawisko przepływu prądu elektrycznego przez dany ośrodek pod wpływem zewnętrznego pola elektrycznego. Wartości przewodności elektrycznej właściwej dzielą ciała stałe na: przewodniki (), półprzewodniki () i izolatory ()
jest to dziesięciostopniowa skala określająca twardość minerałów. Została stworzona przez Friedricha Mohsa w roku
właściwość niektórych ciał stałych, będących nadprzewodnikami polegająca na zaniku oporu elektrycznego po oziębieniu ich do temperatury , niższej od temperatury krytycznej
to usuwanie materiału z powierzchni w wyniku oddziaływania impulsów laserowych o odpowiedniej gęstości energii (napromienieniu wyrażanym w )
są to związki chemiczne o cząsteczkach nieróżniących się od siebie ani masą, ani liczbą atomów, ani rodzajem, natomiast mające różny sposób lub kolejność połączeń tych atomów lub też rozmieszczeniem ich w przestrzeni
inaczej współczynnik sprężystości podłużnej lub moduł sprężystości podłużnej – jest to wielkość określająca własności sprężyste ciała stałego, oznaczana symbolem , charakteryzująca podatność materiału na odkształcenia podłużne przy rozciąganiu, ściskaniu lub zginaniu
jest to cząstka elementarna nie mająca ładunku elektrycznego
Bibliografia
Encyklopedia PWN,
Bielański A., Podstawy chemii nieorganicznej, Warszawa 1994.
Hejwowska S., Marcinkowski R., Chemia ogólna i nieorganiczna, Gdynia 2005.
Tohidinia M., Noroozifar M., Investigation of Carbon Allotropes for Simultaneous Determination of Ascorbic Acid, Epinephrine, Uric Acid, Nitrite and Xanthine, International Journal of ELECTROCHEMICAL SCIENCE, vol. 13, 2018.
Kroto H., Heath J., O'Brien S., Curl R., Smalley R., C60: Buckminsterfullerene, Nature 318, str. 162–163, 1985.
Howard J., McKinnon J., Johnson M., Makarovsky Y., Lafleur A., Production of C60 and C70 fullerenes in benzene‑oxygen flames, Journal of Physical Chemistry 96, str. 6657–6662, 1992.
Szadkowski B., Pingot M., Nanorurki węglowe – materiał przyszłości, Eliksir, nr 1(3), 2016.
Marczak J., Zagadnienie wykorzystania ablacji laserowej w usuwaniu wtórnych nawarstwień z powierzchni dzieł sztuki i obiektów zabytkowych w architekturze, Ochrona Zabytków 54/3 (214), 233–251, 2001.