Reakcje wymiany
Człowiek od dawna prowadzi próby przetwarzania różnorodnych surowców w celu uzyskania bardziej użytecznych materiałów. Na przykład przeobraża pewne skały bogate w związki metali (rudy), otrzymując wolne pierwiastki, np. żelazo czy glin. Przeprowadzane reakcje mają pewne wspólne cechy, które zostaną omówione w tym module.
że synteza i analiza to przykłady reakcji chemicznych;
synteza (łączenie) jest reakcją, w wyniku której z dwóch lub większej liczby substancji powstaje tylko jedna substancja – bardziej złożona;
analiza (rozkład) jest reakcją, w wyniku której z jednej substancji złożonej powstają co najmniej dwie inne;
cyfry zapisywane przed symbolami i wzorami substancji w równaniach reakcji chemicznej to współczynniki stechiometryczne.
wyjaśniać, co to są reakcje wymiany;
rozpoznawać reakcje wymiany na podstawie ich równań;
opisywać doświadczenia chemiczne, uwzględniając: szkło i sprzęt laboratoryjny, odczynniki chemiczne, schemat aparatury;
formułować obserwacje i wnioski z doświadczeń;
przestrzegać zasad BHP podczas wykonywania doświadczeń chemicznych.
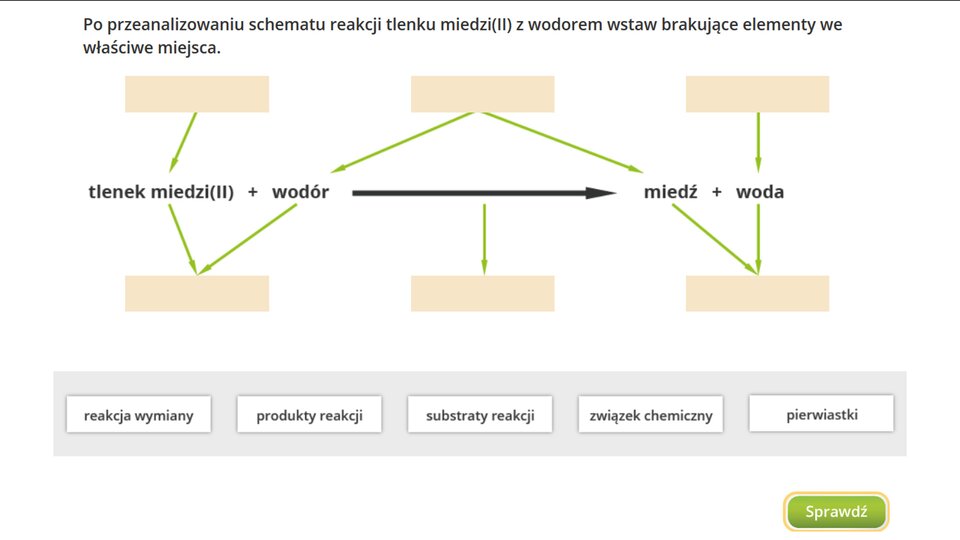
1. Co to są reakcje wymiany?
Przyjrzyj się poniższym równaniom reakcji.

W efekcie każdej z tych przemian z dwóch różnych substratów powstają dwa inne produkty.
Równanie reakcji | Substraty | Produkty |
, | , | |
, | , |
Przedstawione reakcje przebiegają według schematu:
O tego typu reakcjach mówi się, że są to reakcje wymianyreakcje wymiany.
Co dzieje się podczas reakcji tlenku ołowiu(II) z węglem? Jaki to typ reakcji?
Węgiel odbiera tlen z tlenku ołowiu(II). Zachodzi reakcja wymiany.
węgiel drzewny,
tlenek ołowiu(II),
dmuchawka,
łopatka dentystyczna,
parownica,
statyw i łapa (kółko) do osadzenia parownicy,
palnik gazowy.
W kawałku węgla drzewnego wykonaj wgłębienie (wybrane z wgłębenia okruchy pozostaw – będą potrzebne w dalszej części doświadczenia).
Wprowadź do wgłębienia niewielką ilość tlenku ołowiu(II), tak aby wypełnił je tylko częściowo.
Wymieszaj tlenek ołowiu(II) z okruchami węgla drzewnego otrzymanego podczas robienia wgłębienia.
Zapal palnik gazowy i za pomocą dmuchawki skieruj gorący płomień na mieszaninę tlenku ołowiu(II) z węglem.
Obserwuj zachodzące zmiany.
Ogrzewany w płomieniu palnika węgiel drzewny rozżarza się. Po pewnym czasie na powierzchni mieszaniny tlenku ołowiu(II) z węglem drzewnym pojawiają się srebrzyste kuleczki.
Pod wpływem wysokiej temperatury tlenek ołowiu(II) reaguje z węglem i powstaje ołów, który wydziela się z mieszaniny reakcyjnej w postaci srebrzystych kuleczek. Węgiel przekształca się w tlenek węgla(IV).
Przebieg tej reakcji opisuje równanie:
Film dostępny na portalu epodreczniki.pl
Film rozpoczyna ujęcie żółtego tlenku ołowiu dwa na szkiełku zegarkowym oraz kawałka węgla drzewnego. Przy obydwu substancjach znajdują się podpisy. Zmiana ujęcia na przedstawiające wnętrze parownicy w którym leży kawałek węgla drzewnego z wydrążoną dziurą. Do dziury wsypywany jest tlenek ołowiu i mieszany z okruchami węgla. Na tak przygotowane palenisko kierowany jest płomień małego palnika ręcznego, czyli tak zwanej dmuchawki. Następuje przejście w takie samo ujęcie, ale już z rozżarzonym węglem drzewnym. Kolejna zmiana ujęcia na wypalony do białości węgiel. W zagłębieniu widać metaliczne kuleczki, pod którymi pojawia się napis ołów. Obraz zostaje zastąpiony czarną planszą, na której stopniowo pojawia się równanie reakcji: tlenek ołowiu dwa plus węgiel daje ołów plus tlenek węgla cztery. Równanie zapisane symbolicznie zostaje podzielone na dwie części różnymi kolorami tekstu. Część lewa, czerwona otrzymuje podpis Substraty, natomiast część prawa, niebieska otrzymuje podpis Produkty. Podpis pod planszą głosi Reakcja wymiany.
W jaki sposób żelazo reaguje z chlorkiem miedzi(II)? Jaki to typ reakcji?
Żelazo zajmie miejsce miedzi w chlorku miedzi(II). Zajdzie reakcja wymiany.
zlewka,
szczypce,
cylinder miarowy,
gwóźdź (blaszka lub inny przedmiot) wykonany z żelaza,
chlorek miedzi(II),
woda.
Do zlewki wsyp kilka łyżeczek chlorku miedzi(II).
W tej substancji umieść gwóźdź lub inny przedmiot wykonany z żelaza.
Obserwuj, czy zmieszane substancje reagują ze sobą.
Wyjmij żelazny przedmiot, a do chlorku miedzi(II) wlej kilkadziesiąt cmIndeks górny 33 wody (powstały roztwór powinien być niebieski).
W otrzymanym roztworze zanurz wykonany z żelaza gwóźdź do połowy jego wysokości.
Obserwuj zachodzące zmiany.
Po zmieszaniu stałych substancji ze sobą nie obserwujemy żadnych widocznych zmian. Po włożeniu do wodnego roztworu chlorku miedzi(II) żelaznego przedmiotu na powierzchni tego przedmiotu, w części zanurzonej w niebieskim roztworze, pojawił się czerwonopomarańczowy nalot.
Żelazo wyparło miedź z wodnego roztworu chlorku miedzi(II). Miedź wydzieliła się z roztworu w stanie wolnym. Zaszła reakcja wymiany:
Film dostępny na portalu epodreczniki.pl
Film rozpoczyna ujęcie zamkniętego słoja opisanego Miedziany chlorek krystaliczny, szkiełka zegarkowego i gwoździa. W tle widać fragment tułowia i ręce demonstratora w rękawiczkach ochronnych. Zmiana ujęcia, następuje zbliżenie stołu i przejazd ze szkiełka z niebieską substancją na gwóźdź. Zmiana ujęcia na wnętrze parownicy w którym jest niewielka ilość chlorku miedzi dwa oraz gwóźdź. Zmiana ujęcia na przedstawiające zlewkę z około 100 mililitrami wody. Turkusowy chlorek miedzi zostaje do niej wsypany i wymieszany do rozpuszczenia szklaną pałeczką, czyli bagietką. Następnie demonstrator za pomocą długich szczypców wkłada gwóźdź do zlewki tak, że dolna jego połowa zostaje zanurzona. W lewym górnym rogu pojawia się rysunek zegara odliczającego czas kilku godzin. Następuje zmiana ujęcia na takie, w którym zlewka znajduje się po prawej stronie ekranu, a centralną część zajmuje bibuła, na którą demonstrator kładzie wyjęty z roztworu gwóźdź. Dolna połowa tego ostatniego pokryta jest brązową warstwą miedzi. Film zostaje wygaszony, na ekranie pojawia się wycinek kadru ze zbliżeniem gwoździa. Poniżej, na czarnym tle pojawia się zapis reakcji: żelazo plus chlorek miedzi dwa daje miedź plus chlorek żelaza dwa. Pojawia się podpis: Reakcja wymiany, żelazo wykazuje większą aktywność niż miedź.
2. Które przemiany chemiczne można nazwać reakcjami wymiany?
W tym zagadnieniu zostaną zaprezentowane przykłady reakcji wymiany, w wyniku których z dwóch różnych substratów powstają dwa inne produkty.
Równanie reakcji | ||||
Reakcja ta przebiega według schematu:
Do spawania szyn kolejowych i tramwajowych używa się mieszaniny glinu w postaci pyłu z tlenkiem żelaza(III). Mieszaniną tą wypełnia się szczelinę między szynami, a następnie podpala się wypełnienie. Zachodzi wówczas bardzo gwałtowna przemiana chemiczna (), podczas której tworzy się żelazo w stanie płynnym. Stygnąc, żelazo spaja ze sobą dwa fragmenty szyn. Stosowana przy spawaniu szyn metoda z wykorzystaniem glinu to aluminotermii.

Równanie reakcji | ||||
Reakcja ta przebiega według schematu:
Podczas otrzymywania żelaza z jego rud na pewnym etapie procesu tlenek żelaza(III) reaguje z tlenkiem węgla(II), który odbiera tlen z tlenku żelaza(III) co uwzględniono w schematu reakcji:

Równanie reakcji | ||||
Reakcję tę można przedstawić w postaci schematu:
Tytan z uwagi na swoje właściwości (dużą wytrzymałość mechaniczną, odporność na korozję, niską masę) jest metalem wykorzystywanym do produkcji przedmiotów, od których wymaga się, aby były wytrzymałe i jednocześnie lekkie. Z tytanu i jego stopów produkuje się między innymi sprzęt sportowy oraz elementy pojazdów sportowych i samolotów. Jedną z metod otrzymywania tego metalu jest reakcja wymiany chlorku tytanu(IV) z magnezem, w czasie której magnez wypiera tytan z jego związku ().

Zastosowanie reakcji wymiany w metalurgii
Reakcje wymiany znalazły szerokie zastosowanie w metalurgii – do otrzymywania wolnych metali. Już ponad 3500 lat temu ludzie nauczyli się wytapiać metale z ich rud. W pierwszym etapie rudę poddawano działaniu wysokiej temperatury, co umożliwiało przeprowadzenie zawartego w niej związku chemicznego metalu w jego tlenek. Następnie tlenek metalu ogrzewano z węglem drzewnym. Podczas tego procesu węgiel łączył się z tlenem zawartym w tlenku metalu (odbierał od niego tlen) i w ten sposób pozyskiwano metal.
Podczas opisanej przemiany z dwóch różnych substratów, tlenku metalu i węgla, powstają dwa inne produkty: metal i tlenek węgla(IV). Przemiana ta jest przykładem reakcji wymiany.

3. Reakcja redukcji tlenku jako przykład reakcji wymiany
Reakcja łączenia się substancji z tlenem nazywa się reakcją utleniania*. Przemiana, w której tlenek ulega „odtlenieniu”, określana jest mianem reakcji redukcjireakcji redukcji*. Wszystkie poznane w tym module reakcje, w wyniku których z tlenku metalu powstawał metal, są przykładami reakcji redukcji. O substancji odbierającej tlen od tlenku metalu mówi się, że redukuje ona tlenek.
*Podczas nauki chemii w zakresie rozszerzonym poznacie współczesną interpretację tego pojęcia.
Zapis słowny przebiegu reakcji | Równanie reakcji chemicznej | Substancja |
węgiel | ||
tlenek węgla(II) | ||
węgiel | ||
glin | ||
wodór |
W metalurgii bardzo często do redukcji tlenków metali wykorzystuje się węgiel. Jego źródła są stosunkowo tanie i łatwo dostępne. Jednak za jego pomocą można zredukować tylko niektóre tlenki metali. Należą do nich na przykład tlenki: cynku, żelaza, ołowiu, miedzi. Tlenki te, ogrzewane z węglem, redukują się do wolnych pierwiastków, podczas gdy węgiel utlenia się. Jednak wielu tlenków metali nie udaje się zredukować za pomocą węgla. Do otrzymywania czystych pierwiastków stosuje się wtedy inne metody.
4. Reakcje wymiany pojedynczej i podwójnej
Wśród reakcji wymiany wyróżnia się reakcje wymiany pojedynczejreakcje wymiany pojedynczej i reakcje wymiany podwójnejreakcje wymiany podwójnej. Pierwszy rodzaj, reakcja wymiany pojedynczej, jest przemianą, podczas której dwa substraty (pierwiastek i związek chemiczny) przekształcają się w dwa produkty (nową substancję prostą i złożoną). Jej przebieg można opisać za pomocą następującego schematu:
Równanie reakcji chemicznej | Zapis słowny przebiegu reakcji |
Druga grupa to reakcje wymiany podwójnej. Zachodzą one wtedy, gdy dwie substancje złożone przekształcają się w dwa nowe związki chemiczne. Poniższy schemat obrazuje przebieg reakcji wymiany podwójnej:
Równanie reakcji chemicznej | Zapis słowny przebiegu reakcji |
Podsumowanie
Obok reakcji analizy i syntezy istnieje trzeci typ reakcji – reakcja wymiany.
Reakcja wymiany jest przemianą, podczas której następuje wymiana składników pomiędzy reagującymi substancjami. Przebiega ona według schematu:
.Reakcje wymiany można podzielić na dwie grupy: reakcje wymiany pojedynczej i reakcje wymiany podwójnej.
Reakcja wymiany pojedynczej to przemiana, podczas której dwa substraty (pierwiastek i związek chemiczny) przekształcają się w dwa produkty (nową substancję prostą i złożoną).
Reakcja wymiany podwójnej jest przemianą, podczas której dwie substancje złożone przekształcają się w dwa związki chemiczne.
Reakcja redukcji (redukcja) jest przemianą chemiczną, podczas której substancja złożona (tlenek) oddaje tlen.
Reakcja redukcji jest przykładem reakcji wymiany.
Korzystając z dowolnych materiałów (na przykład plasteliny, kasztanów, klocków itp.), wykonaj model przedstawiający przebieg reakcji wymiany pojedynczej i wymiany podwójnej.
Ołów występuje w przyrodzie głównie w postaci siarczku ołowiu(II) – . Z tej substancji w wyniku reakcji chemicznych uzyskuje się ołów. W pierwszym etapie siarczek ołowiu(II) praży się na wolnym powietrzu. Podczas tego procesu związek ten reaguje z tlenem, a produktami reakcji są tlenek ołowiu(II) i tlenek siarki(IV). W dalszym etapie tlenek ołowiu(II) ogrzewa się w wysokiej temperaturze z węglem i otrzymuje się ołów oraz tlenek węgla(IV).
Na podstawie powyższych informacji zapisz dwa równania reakcji prowadzące do uzyskania ołowiu z siarczku ołowiu(II). Wskaż równanie opisujące reakcję wymiany.
Słowniczek
przemiana chemiczna, podczas której substancja złożona (tlenek) oddaje tlen (współczesną interpretację tego pojęcia poznacie w trakcie nauki chemii w zakresie rozszerzonym)
przemiana chemiczna, podczas której z co najmniej dwóch substratów powstają co najmniej dwa produkty
przemiana, podczas której dwie substancje złożone (związki chemiczne) przekształcają się w dwie nowe substancje złożone (związki chemiczne)
przemiana, podczas której dwa substraty (pierwiastek i związek chemiczny) przekształcają się w co najmniej dwa produkty (nową substancję prostą i złożoną)
Zadania
Oceń, czy poniższe zdania są prawdziwe, czy fałszywe.
| Prawda | Fałsz | |
| Każda reakcja chemiczna, w której powstają dwa produkty, jest reakcją wymiany. | □ | □ |
| Reakcja wymiany jest przemianą, w której następuje wymiana składników pomiędzy reagującymi substancjami. | □ | □ |
| Substratami w reakcji wymiany nie mogą być dwa pierwiastki. | □ | □ |
Uzgodnij równanie reakcji wymiany. Wskaż ciąg liczb określających kolejne współczynniki stechiometryczne w równaniu reakcji:
- 1, 1, 1, 1
- 2, 1, 2, 1
- 1, 2, 1, 2
- 2, 2, 2, 2
- 2, 3, 2, 3
Uzgodnij równanie reakcji wymiany. Wskaż ciąg liczb określających kolejne współczynniki stechiometryczne reakcji:
- 1, 1, 1, 1
- 2, 1, 2, 1
- 2, 1, 1, 2
- 1, 1, 1, 2
- 1, 2, 2, 1
Uzgodnij równanie reakcji wymiany. Wskaż ciąg liczb określających kolejne współczynniki stechiometryczne reakcji:
- 1, 2, 1, 2
- 1, 1, 1, 2
- 2, 3, 2, 2
- 1, 2, 1, 1
- 3, 2, 3, 3
Wskaż substrat, którego brak w uzgodnionym równaniu reakcji:
Rozwiąż zadanie.
Zasób interaktywny dostępny pod adresem https://zpe.gov.pl/a/D463f4pmK