Sole – budowa, właściwości, otrzymywanie i zastosowanie
Poniższy materiał stanowi uzupełnienie treści zawartych w materiale: https://zpe.gov.pl/a/sole–podsumowanie/D16N5uH0u
Wyobraź sobie doświadczenie chemiczne, w którym wrzucasz oczyszczoną skorupkę jaja kurzego do zlewki z kwasem chlorowodorowym, czyli kwasem solnym. Reakcji towarzyszy intensywne wydzielanie gazu. Po pewnym czasie skorupka jaja całkowicie się roztwarza, a w zlewce pozostaje roztwór. Jaka reakcja chemiczna zaszła w zlewce? Z czego składa się skorupka jaja kurzego i dlaczego reakcji towarzyszy wydzielanie gazu?
budowę tlenków, kwasów i wodorotlenków;
reakcję zobojętniania kwasów przez zasady;
nazwy tlenków, kwasów i wodorotlenków.
przedstawiać budowę soli,
pisać równania reakcji otrzymywania soli,
analizować doświadczenia chemiczne z udziałem soli,
odróżniać właściwości fizyczne od chemicznych soli,
wymieniać zastosowania soli w życiu codziennym
Sole to w większości substancje jonowe. Zawierają bowiem w swojej budowie kationykationy metali (lub kationy amonu) i anionyaniony reszty kwasowej. Ich wzór ogólny można przedstawić następująco:
gdzie:
to najczęściej kation prosty metalu (np. , , ) lub kation złożony (np. kation amonu );
to wartościowość metalu (równa liczbie anionów reszty kwasowej);
to reszta kwasowa (np. pochodząca od kwasu , , );
to wartościowość reszty kwasowej (równa liczbie kationów metalu lub kationów amonu).
W temperaturze pokojowej sole występują w stałym stanie skupienia i najczęściej mają budowę krystaliczną.

Większość soli ma barwę białą lub jest bezbarwna. Jednak niektóre z nich są barwne, np. (barwa fioletowa), (barwa żółta) czy (barwa czarna).
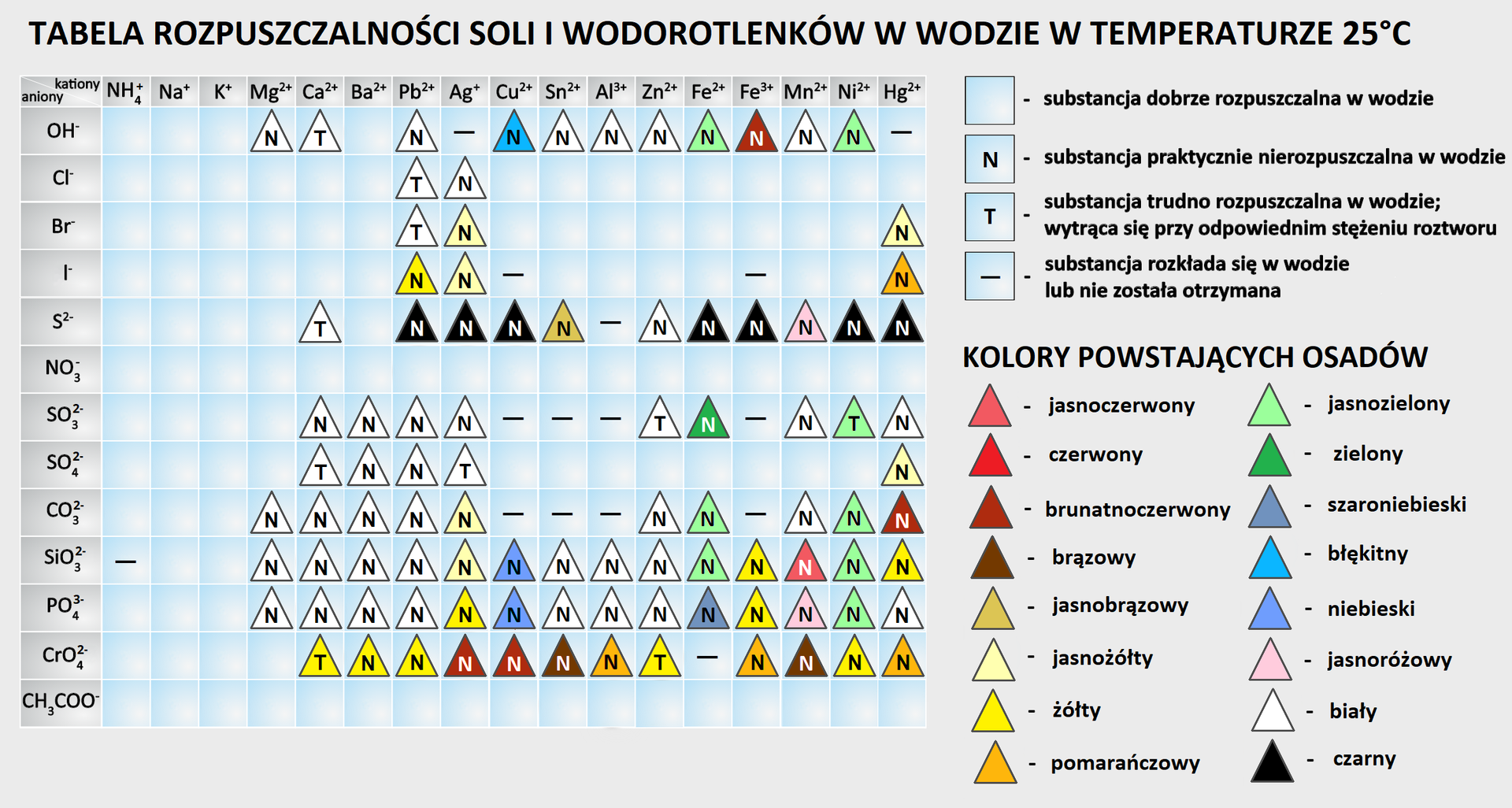
Pod względem rozpuszczalności, sole są bardzo zróżnicowane. Aby sprawdzić, która sól jest dobrze rozpuszczalna w wodzie, a która trudno rozpuszczalna, należy skorzystać z tabeli rozpuszczalności soli.
Do właściwości chemicznych soli należy możliwość dysocjacji elektrolitycznejdysocjacji elektrolitycznej. Jest to proces rozpadu związku chemicznego na jonyjony pod wpływem rozpuszczalnika, np. wody. Bez względu na to, czy dana sól jest łatwo, czy trudno rozpuszczalna w wodzie, ta ilość soli, która ulega rozpuszczeniu, rozpada się na jony.
Sole, które są rozpuszczalne w wodzie, ulegają dysocjacji elektrolitycznej całkowicie. Oznacza to, że w roztworze wodnym danej soli występują wyłącznie kationy i aniony.
W przypadku soli trudno rozpuszczalnych w wodzie, tylko część soli ulegnie rozpuszczeniu i dysocjacji elektrolitycznej. Zatem stężenie jonów w wodzie jest niewielkie. Dlatego zazwyczaj soli trudno rozpuszczalnych w wodzie nie rozpisujemy na jony.
Do najważniejszych metod otrzymywania soli należą:
Reakcja kwasu z wodorotlenkiem (reakcja zobojętniania):
Reakcja tlenku kwasowego z wodorotlenkiem:
Reakcja tlenku zasadowego z kwasem: <equation
Reakcja tlenku kwasowego z tlenkiem zasadowym:
Reakcja metalu z kwasem:
Reakcja metalu z niemetalem:
Reakcja mocnych kwasów z siarczanami() lub węglanami:
Reakcja soli z solami:
Reakcja soli z wodorotlenkami i grupy układu okresowego pierwiastków (tak zwanymi mocnymi zasadami):
Poniżej przedstawiono schemat pewnego doświadczenia.
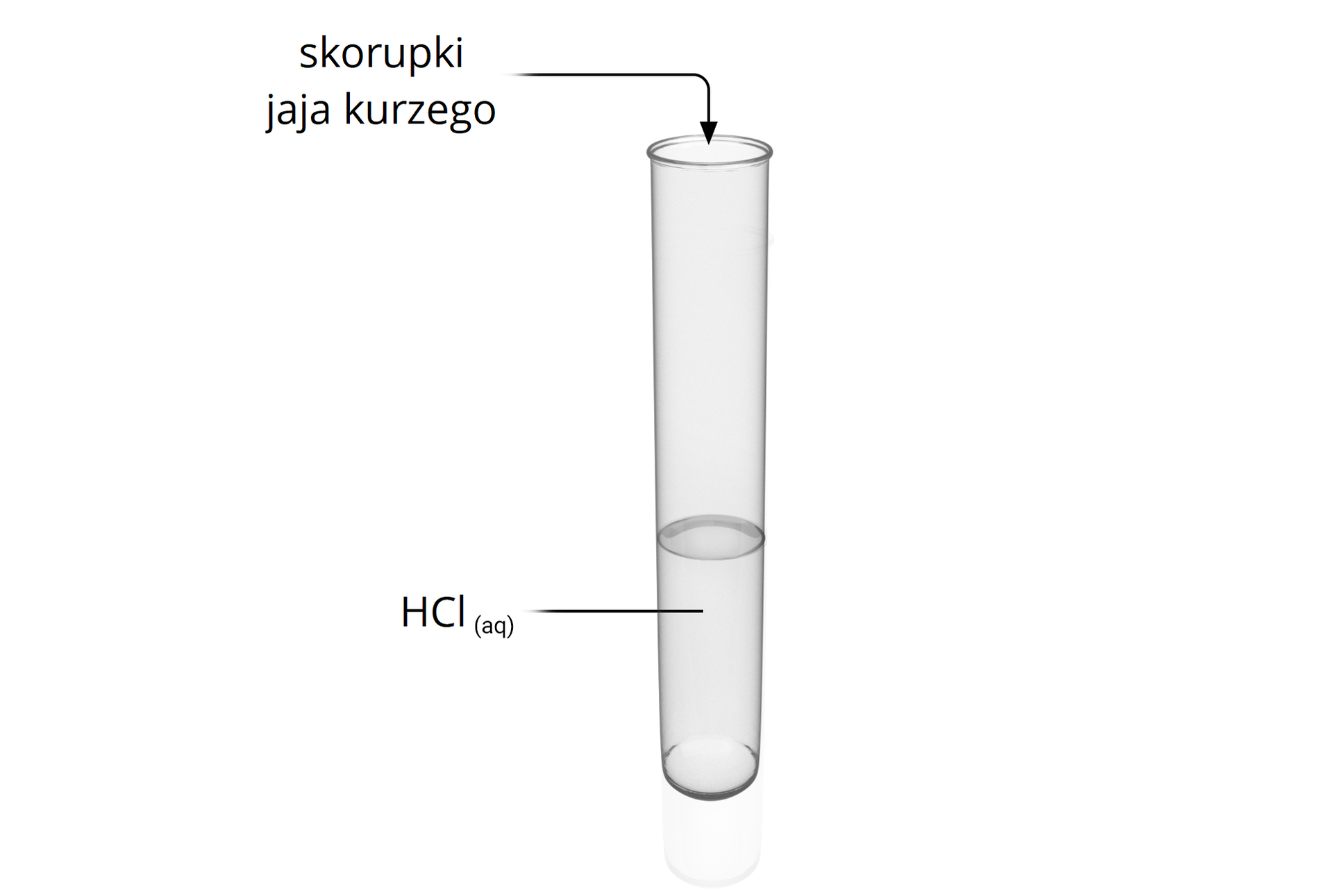
Pewien uczeń zapisał swoje obserwacje po wykonaniu doświadczenia:
Pewien uczeń przeprowadził doświadczenie chemiczne polegające na dodaniu skorupek jaja kurzego do kwasu chlorowodorowego. Następnie zapisał on swoje obserwacje:
„Skorupki jaja kurzego roztworzyły się. Zaczął wydzielać się bezbarwny, bezwonny gaz. Po pewnym czasie w zlewce pozostała jedynie ciecz.”
Do najważniejszych reakcji, jakim ulegają sole, należą reakcje ich rozkładu. Najczęściej mamy do czynienia z rozkładem termicznym. Powstaje wówczas tlenek metalu i tlenek niemetalu.
Możliwy jest również rozpad soli pod wpływem promieni świetlnych. Na przykład bromek srebra() ulega takiemu rozkładowi. Dzięki temu znalazł zastosowanie w fotografii, będąc składnikiem między innymi światłoczułych emulsji fotograficznych.
Sole znalazły liczne zastosowania w: gospodarstwie domowym, rolnictwie, przemyśle chemicznym, budownictwie i medycynie. Stanowią między innymi środki konserwujące, składniki nawozów sztucznych, zaprawy murarskie czy opatrunki gipsowe.
Mapa pojęć
Mapa pojęć ukazuje budowę, właściowości, otrzymywanie i zastosowania soli. Zielony węzeł opisuje budowę. Sole to substancje krystaliczne o budowie jonowej. Składają się z kationów metali (lub np. kationu amonu) oraz anionów reszt kwasowych. Przedstawiono następujący wzór sumaryczny: kolorem zielonym , opisane jako kation metalu , a dalej kolorem czerwonym , opisane jako anion reszty kwasowej kwasu .
Pomarańczowy węzeł opisuje otrzymywanie. Przedstawiono różne równania reakcji.
Reakcja tlenku kwasowego z wodorotlenkiem:
tlenek węgla cztery plus wodorotlenek sodu strzałka w prawo węglan sodu plus woda
Reakcja kwasu z wodorotlenkiem:
kwas bromowodorowy plus wodorotlenek potasu strzałka w prawo bromek potasu plus woda
Reakcja tlenku zasadowego z kwasem:
tlenek żelaza dwa plus kwas chlorowodorowy strzałka w prawo chlorek żelaza dwa plus woda
Reakcja soli z wodorotlenkami pierwszej i drugiej grupy układu okresowego pierwiastków (tak zwanymi mocnymi zasadami):
chlorek żelaza trzy plus wodorotlenek sodu strzałka w prawo wodorotlenek żelaza trzy plus chlorek sodu
Reakcja tlenku kwasowego z tlenkiem zasadowym:
tlenek potasu plus tlenek siarki cztery strzałka w prawo siarczan cztery potasu
W reakcji otrzymywania, w której bierze udział tlenek niemetalu, powstają sole kwasów tlenowych.
Reakcja metalu z kwasem:
magnez plus kwas siarkowy sześć strzałka w prawo siarczan cztery magnezu plus wodór
Nie wszystkie metale reagują w ten sposób z kwasami. Te metale, które leżą w szeregu aktywności metali za atomem wodoru, nie wypierają go z kwasów, np. czy .
Reakcja metalu z niemetalem:
glin plus siarka strzałka w prawo siarczek glinu
Powstają jedynie sole kwasów beztlenowych.
Reakcja mocnych kwasów z siarczanami() lub węglanami:
kwas bromowodorowy plus siarczan cztery wapnia strzałka w prawo bromek wapnia tlenek siarki cztery plus woda
Reakcja soli z solami:
chlorek wapnia plus fosforany pięć sodu strzałka w prawo fosforany pięć wapnia plus chlorek sodu
Należy pamiętać, że jedną z otrzymywanych soli musi być sól słabo lub trudno rozpuszczalna w wodzie.
Kremowy węzeł opisuje zastosowania. Sole wykorzystywane są w budownictwie, do gipsowania ścian stosuje się między innymi siarczan() wapnia. Zamieszczono ilustrację ukazującą fragment sufitu z kwadratowym wgłębieniem. Ręka ubrana w czerwono–zieloną, ubrudzoną na biało bluzkę, nakłada szpachelką gips na brzegi wgłębienia. W medycynie sole wykorzystuje się sól fizjologiczną, czyli –procentowy roztwór chlorku sodu () stosowana w medycynie do uzupełniania niedoborów kationów sodu i anionów chlorkowych. Zamieszczono ilustrację przedstawiającą metalowy stojak, na którym zawieszone są trzy torebki z kroplówką, W lewym dolnym rogu zdjęcia znajduje się dłoń sięgająca po jedną z torebek. Składnikiem proszku do pieczenia, wykorzystywanego w gospodarstwach domowych, jest między innymi wodorowęglan amonu (). W procesie jego rozkładu termicznego powstaje między innymi tlenek węgla(), który spulchnia ciasto. Zamieszczono ilustrację przedstawiającą leżący bokiem, na białym, porcelanowym talerzu, kawałek czekoladowego tortu. Obok ciasta leży biały widelec. W rolnictwie stosuje się nawozy, aby uzupełnić niedobory składników odżywczych dla roślin. W większości są to sole, między innymi , , , czy .
Czerwony węzeł opisuje właściwości chemiczne i fizyczne soli. Opis właściwości chemicznych podzielono na: dysocjację elektrolityczną, reakcje strąceniowe i reakcje rozkładu. Dysocjacja elektrolityczna to rozpad elektrolitu na jony pod wpływem wody. W jego wyniku do roztworu uwalniane są kationy metali (lub kation amonu) i aniony reszty kwasowej. Zamieszczono następujące równania reakcji:
chlorek amonu strzałka w prawo nad strzałką woda za strzałką kation amonowy plus anion chlorkowy
azotan pięć baru strzałka w prawo nad strzałką woda za strzałką kation baru plus anion azotanowy pięć
Sole ulegają między innymi reakcjom strąceniowym. W ich wyniku wyniku otrzymujemy osady, czyli substancje stałe wydzielone z roztworu. Reakcje strąceniowe, którym ulegają sole należą do typu reakcji wymiany podwójnej, w której substratami są sole i zasady, sole i kwasy lub dwie sole. Zamieszczono przykładowe równania reakcji (w równaniach reakcji strzałką skierowaną w dół zaznaczamy substancję powstającą w postaci osadu (strąconą)):
sól pierwsza plus wodorotlenek pierwszy strzałka w prawo sól druga plus wodorotlenek drugi strzałka w dół
sól pierwsza plus sól druga strzałka w prawo sól trzecia strzałka w dół plus sól czwarta lub sól pierwsza plus sól druga strzałka w prawo sól trzecia plus sól czwarta strzałka w dół
sól pierwsza plus wodorotlenek pierwszy strzałka w prawo sól druga strzałka w dół plus wodorotlenek drugi
sól pierwsza plus kwas pierwszy strzałka w prawo sól druga strzałka w dół plus kwas drugi
Rozkład termiczny soli kwasów tlenowych często prowadzi do powstania tlenków.
węglan cynku strzałka w prawo tlenek cynku plus tlenek węgla cztery
Niektóre sole ulegają rozkładowi pod wpływem światła. Na przykład rozkład soli beztlenowej może prowadzić do otrzymania metalu i niemetalu.
chlorek srebra strzałka w prawo nad strzałką światło za strzałką srebro plus chlor
Właściwości fizyczne podzielono na: stan skupienia, barwy, rozpuszczalność w wodzie i temperaturę topnienia. Sole w temperaturze pokojowej to ciała stałe najczęściej o budowie krystalicznej. Większość soli ma barwę białą. Jednak występują również sole bezbarwne lub charakteryzujące się różnymi barwami. Węglan wapnia ma barwę białą. Zamieszczono ilustrację przedstawiającą szaro–białe kostki węglanu wapnia. tworzy ciemnofioletowe kryształy. Zamieszczono ilustrację przedstawiającą szalkę, na której znajduje się stosik drobnych, ciemnych kryształków. Wytrącony w roztworze. Zamieszczono ilustrację przedstawiającą zlewkę, w której znajduje się sto dwadzieścia pięć mililitrów żółto–pomarańczowej, przezroczystej, błyszczącej w świetle substancji. Pod względem rozpuszczalności w wodzie, sole są bardzo zróżnicowane. Na rozpuszczalność w wodzie wpływa zarówno kation, jak i anion soli. Wszystkie azotany() oraz sole sodowe, potasowe i amonowe są dobrze rozpuszczalne w wodzie. Natomiast do najbardziej znanych soli trudno rozpuszczalnych w wodzie należą między innymi , , , , , , . Do sprawdzenia rozpuszczalności różnych soli w wodzie służy tabela rozpuszczalności. Pod wpływem temperatury niektóre sole topnieją. Rozerwana zostaje wówczas struktura krystaliczna i uwalniają się kationy i aniony. Na przykład sól (chlorek potasu) topi się w temperaturze równej i w trakcie tego procesu uwalniane są kationy potasu i aniony chlorkowe ze struktury krystalicznej.
Azotan() strontu to sól, która znalazła zastosowanie pirotechnice jako składnik między innymi sztucznych ogni. Zapisz równanie reakcji otrzymywania tej soli za pomocą metody zobojętniania.
Korzystając z tabeli rozpuszczalności zamieszczonej poniżej, dopasuj wymienione sole do odpowiedniej grupy.
Słownik
atom lub grupa atomów z ładunkiem elektrycznym dodatnim lub ujemnym
jon dodatni, np. , ,
jon ujemny, np. , ,
rozpad związku chemicznego na jony, zachodzący pod wpływem rozpuszczalnika polarnego (np. wody)
Ćwiczenia
W wyniku pewnego doświadczenia otrzymano klarowny, niebieski roztwór.

W wyniku pewnego doświadczenia otrzymano klarowny, niebieski roztwór.
Poniżej przedstawiono schemat pewnej reakcji chemicznej, w której powstaje sól.
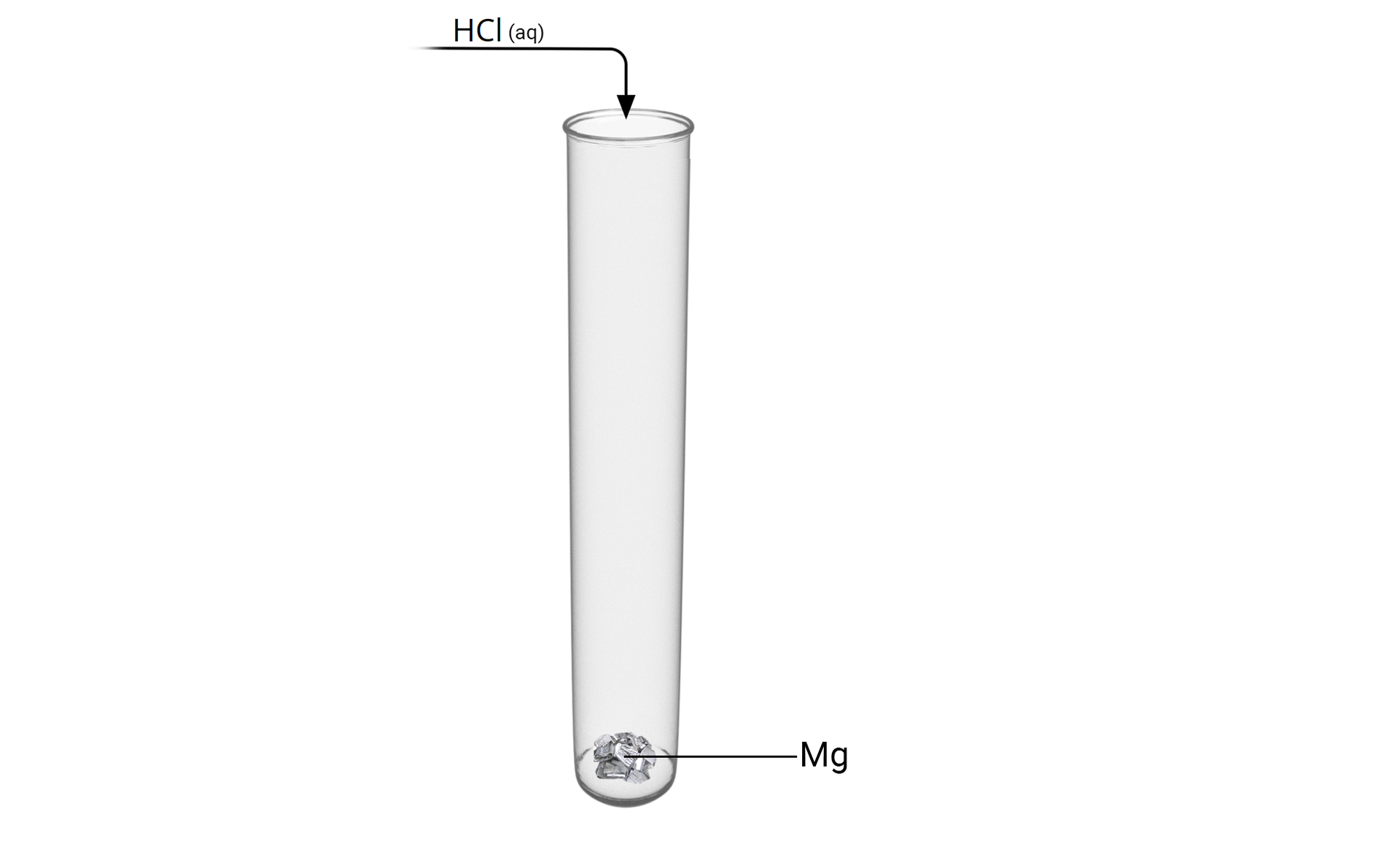
Wybierz nazwę soli, która powstaje podczas reakcji magnezu z kwasem chlorowodorowym.
Wybierz nazwę soli, która powstaje podczas reakcji magnezu z kwasem chlorowodorowym.
Przeprowadził zatem badania, mające na celu ich identyfikację. Próbkę rozdzielił do trzech probówek. Analogicznie postąpił z próbką . Następnie dodał do probówek trzy różne odczynniki. Obserwacje z przebiegu swojego doświadczenia umieścił w tabeli.
Na podstawie wyników zamieszczonych w tabeli oceń, który metal stanowi próbkę , a który próbkę . W tym celu wstaw symbol danego metalu w odpowiednie miejsce.
Trzech uczniów badało właściwości tlenku glinu. Uczeń pierwszy ogrzewał tlenek na łyżce do spalań w płomieniu palnika. Drugi uczeń dodał do niego kwasu chlorowodorowego, a trzeci dolał do probówki z tlenkiem glinu wodę. Tylko jeden z uczniów zaobserwował roztwarzanie tlenku glinu. Zaznacz, który to był uczeń, a następnie zapisz równanie przeprowadzonej przez niego reakcji chemicznej.
Trzech uczniów badało właściwości tlenku glinu. Uczeń pierwszy ogrzewał tlenek na łyżce do spalań w płomieniu palnika. Drugi uczeń dodał do niego kwasu chlorowodorowego, a trzeci dolał do probówki z tlenkiem glinu wodę. Tylko jeden z uczniów zaobserwował roztwarzanie tlenku glinu. Zaznacz, który to był uczeń, a następnie wybierz równanie przeprowadzonej przez niego reakcji chemicznej.
acid carbonate 1. salt hydrogen, 2. salt water, 3. salt water carbon dioxide, 4. salt carbon dioxide
Bibliografia
Bielański A., Podstawy chemii nieorganicznej, t. 1, Warszawa 2022.
Kulawik J., Kulawik T., Litwin M., Podręcznik do chemii dla klasy ósmej szkoły podstawowej, Warszawa 2020.
Łasiński D., Sporny Ł., Strutyńska D., Wróblewski P., Podręcznik dla klasy ósmej szkoły podstawowej, Mac Edukacja 2021.




