Sprawdź się
Rozstrzygnij, czy poniższe stwierdzenia są prawdziwe czy fałszywe.
| Prawda | Fałsz | |
| Krystalizacja jest metodą służącą do oczyszczania substancji stałych. | □ | □ |
| Czystość krystalizowanej substancji można określić na podstawie temperatury wrzenia. | □ | □ |
| Pierwszym etapem procesu krystalizacji jest wzrost kryształu. | □ | □ |
| Rozpuszczalnik użyty do procesu krystalizacji powinien być łatwopalny. | □ | □ |
Wybierz prawidłowe objaśnienia pojęć.
proces polegający na ponownym wzroście kryształów, przebiegający w celu oczyszczenia substancji., proces samorzutnego rozprzestrzeniania i przenikania się cząsteczek (np, w cieczy, gazie), będący konsekwencją chaotycznych zderzeń., proces tworzenia się ciał krystalicznych., początkowy etap krystalizacji, w którym powstają substancje o niewielkich rozmiarach, tzw. zarodki.
| krystalizacja | |
| rekrystalizacja | |
| dyfuzja | |
| nukleacja |
Jedną ze znanych soli, dobrze rozpuszczalnych w wodzie jest siarczan() miedzi(). Ze względu na właściwości grzybobójcze, dostępny jest w sprzedaży m. in w sklepach ogrodniczych. Siarczan() miedzi() w formie bezwodnej to biała sól, jednak ze względu na właściwości higroskopijne, nieprawidłowo przechowywany może absorbować wilgoć z powietrza i zbijać się w większe kryształy. Przeprowadzając poprawnie krystalizację tej soli można otrzymać okazałe kryształy koloru niebieskiego.

Dwóch uczniów przeprowadziło krystalizację siarczanu() miedzi().
Uczeń A: rozpuścił na gorąco kilkanaście gramów drobnego proszku siarczanu() miedzi() w wodzie, tak aby roztwór był bliski nasycenia. Zlewkę przykrył szkiełkiem zegarkowym i pozostawił na kilka dni na półce.
Uczeń B: rozpuścił na zimno niewielką ilość nierozdrobnionego siarczanu() miedzi(). Zawartość zlewki codziennie mieszał i potrząsał.
Odczyn roztworu: 1. , 2. , 3. , 4. , 5. , 6. , 7. , 8. , 9. , 10.
Studentka chciała wykrystalizować kwas -toluilowy (struktura i temperatura topnienia poniżej). Informacje na temat rozpuszczalności w rozpuszczalnikach A, B, C, D prezentuje poniższa tabela.
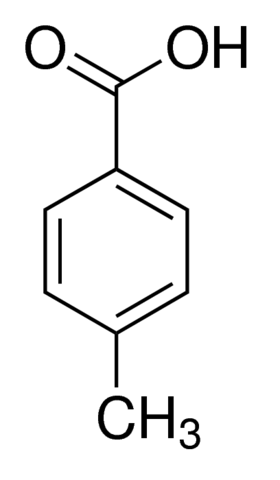
Rozpuszczalnik | Temperatura wrzenia | Rozpuszczalność | Rozpuszczalność |
A | |||
B | |||
C | |||
D |
Który z rozpuszczalników polecisz studentce do krystalizacji tego kwasu? Odpowiedź uzasadnij.
- C
- A
- B
- D
W procesie krystalizacji wykorzystywanym do rozdzielenia składników mieszaniny rozpuszczalnik jest tym lepszy, im większa jest różnica wartości wydajności teoretycznych krystalizacji składników mieszaniny.
Indeks górny Źródło: Stępanik S., Krytalizacja jako metoda rozdzielania substancji organicznych. Indeks górny koniecŹródło: Stępanik S., Krytalizacja jako metoda rozdzielania substancji organicznych.
Wydajność teoretyczna krystalizacji opisana jest wzorem:
– wydajność teoretyczna krystalizacji
– rozpuszczalność w temperaturze wrzenia
– rozpuszczalność w temperaturze chłodzenia
Rozpuszczalność kwasu benzoesowego w wodzie w temperaturze wynosi , a w . Jakiej minimalnej ilości wody trzeba użyć do krystalizacji kwasu? Oblicz wydajność teoretyczną krystalizacji. Wyniki podaj z dokładnością do jednego miejsca po przecinku.
Uczeń ma do dyspozycji mieszaninę roztworu sacharozy i piasku. Dobierz metodę rozdziału mieszaniny tak, aby po rozdziale sacharoza miała postać krystaliczną. Wymień etapy postępowania.
Substancja | Masa molowa | Gęstość w | Temperatura wrzenia | Temperatura topnienia | Rozpuszczalność w wodzie w |
Sacharoza | brak danych | ||||
(kwarc ) | Nierozpuszczalne w wodzie |
Indeks górny Źródło: https://pl.wikipedia.org/wiki/Ditlenek_krzemu Indeks górny koniecŹródło: https://pl.wikipedia.org/wiki/Ditlenek_krzemu
W celu oczyszczenia azotanu() ołowiu() przez krystalizację, rozpuszczono tej substancji w wody w temperaturze wrzenia, a następnie ochłodzono roztwór do temperatury . Oblicz wydajność procentową procesu oczyszczania, jeżeli rozpuszczalność azotanu ołowiu() w temperaturze wynosi .
Student zastosował metanol jako rozpuszczalnik w procesie krystalizacji. Rozpuścił w nim badany związek na gorąco, ale po ochłodzeniu nie otrzymał żadnego kryształu. W jaki sposób student powinien spróbować otrzymać kryształy?