Sprawdź się
Przeanalizuj poniższy wykres, przedstawiający zależność między liczbą atomową a energią jonizacji pierwiastków. Wskaż zależność między liczbą atomową a wartością energii jonizacji w okresach układu okresowego.
Zapoznaj się z opisem wykresu, przedstawiającego zależność między liczbą atomową a energią jonizacji pierwiastków. Wskaż zależność między liczbą atomową a wartością energii jonizacji w okresach układu okresowego.
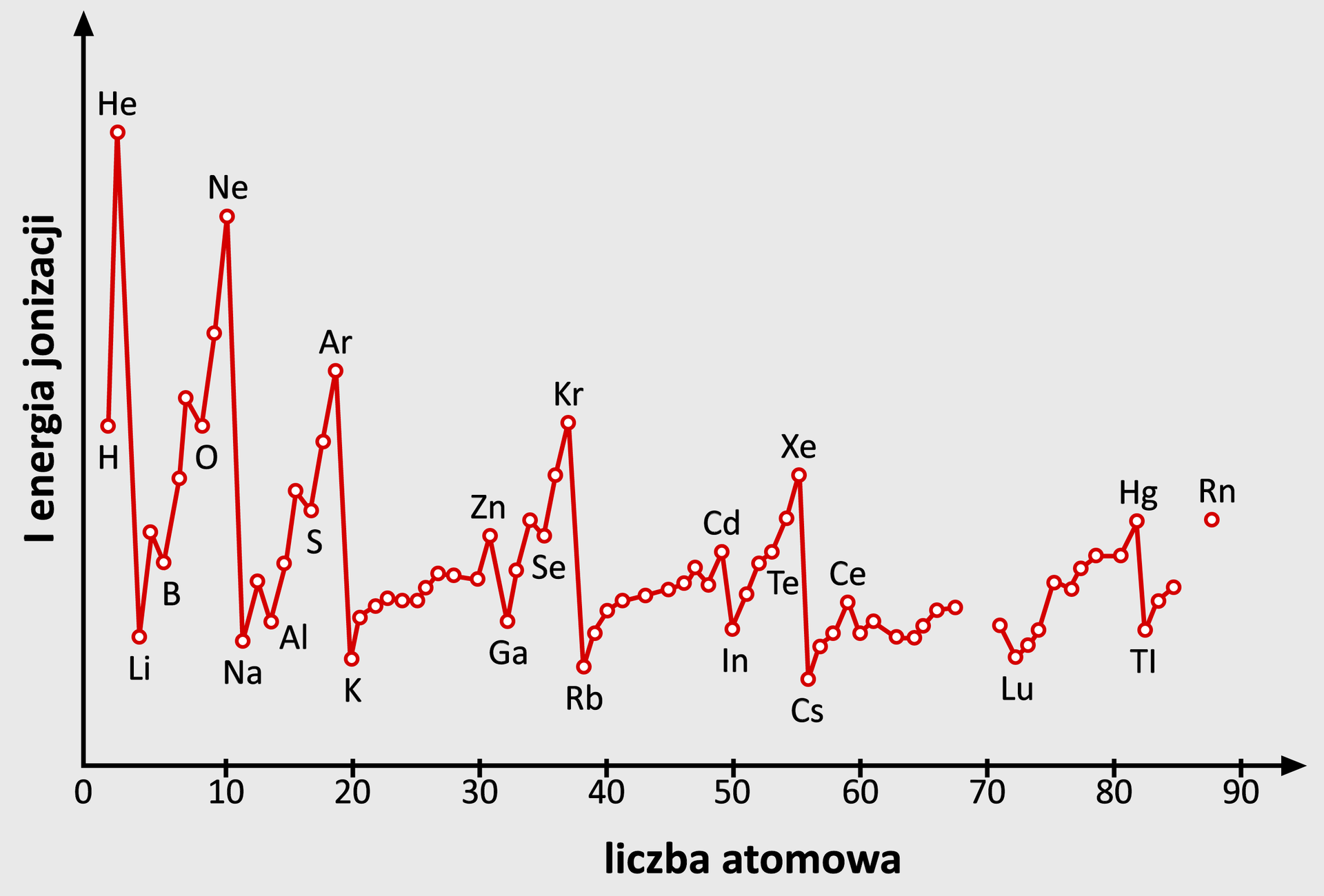
Indeks dolny Źródło: Hejwowska S., Marcinkowski R., Chemia 1 Zakres rozszerzony, Gdynia 2007. Indeks dolny koniecŹródło: Hejwowska S., Marcinkowski R., Chemia 1 Zakres rozszerzony, Gdynia 2007.
Próbkę sodu o masie wrzucono do zlewki z wodą. Po reakcji odczytano, że objętość roztworu wynosi . Oblicz stężenie molowe otrzymanego roztworu.
Próbkę potasu o masie wrzucono do wody o masie . Oblicz stężenie procentowe otrzymanego roztworu. Wynik podaj z dokładnością do dwóch miejsc po przecinku.