Sprawdź się
Pierwiastki grupy 17. układu okresowego reagują z wodorem. Wskaż, który szereg przedstawia je w kolejności od najbardziej do najmniej aktywnego względem wodoru.
W podobny sposób jak chlorowodór z chlorku sodu, także fluorowodór można otrzymać z jego soli. W tym celu wykorzystuje się minerał o nazwie fluoryt (fluorek wapnia). Ze względu na właściwości produktu, reakcję tę przeprowadza się w naczyniu wykonanym z platyny lub ołowiu.
Jakiego substratu użyjesz w tej reakcji? Podaj wzór i nazwę.
Zapisz odpowiednie równanie reakcji.
Wykonując doświadczenia ze stężonymi roztworami fluorowcowodorów, należy zachowywać szczególną ostrożność.
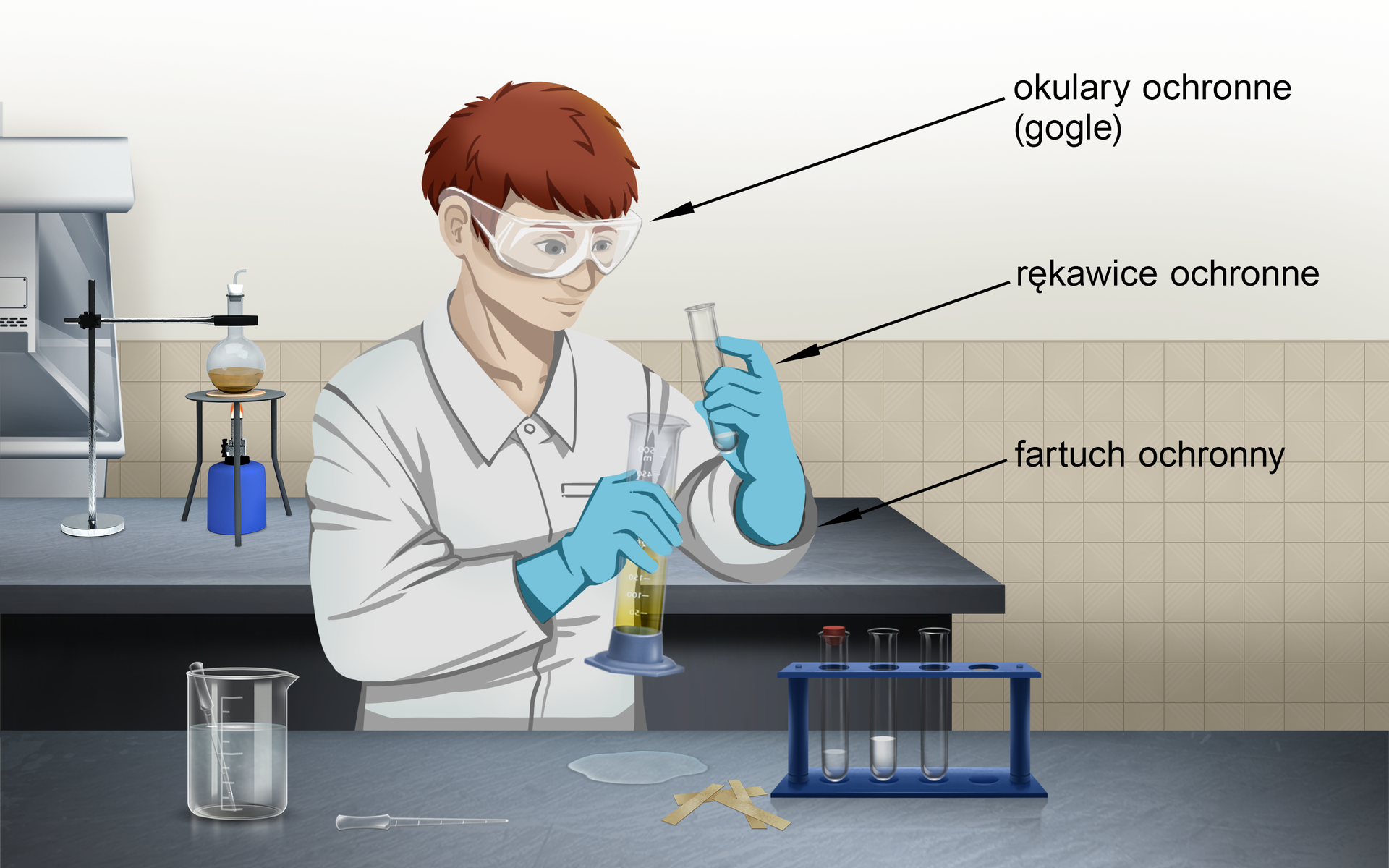
Przyjrzyj się ilustracji i odpowiedz na pytanie, czy przedstawiona sytuacja gwarantuje bezpieczeństwo podczas pracy ze stężonym kwasem chlorowodorowym.
Zapoznaj się z opisem ilustracji i odpowiedz na pytanie, czy przedstawiona sytuacja gwarantuje bezpieczeństwo podczas pracy ze stężonym kwasem chlorowodorowym.
W reakcji syntezy otrzymano 1,12 chlorowodoru (w warunkach normalnych), który następnie rozpuszczono w wodzie, otrzymując 1 roztworu. Stężenie molowe tego roztworu, wyrażone w , wynosiło:
Do reakcji otrzymania fluorowodoru i chlorowodoru użyto 100 96% roztworu kwasu siarkowego(VI).
W której reakcji otrzymamy większą objętość gazowego produktu?
W niektórych reakcjach kwasów ze związkami jonowymi jednym z produktów jest gaz. Tą metodą otrzymuje się w laboratorium wiele gazów. Przykładem może tu być otrzymywanie fluorowcowodorów przez działanie kwasów na halogenki metali. Każdy jon soli odrywa tu jeden jon wodoru z cząsteczki i uchodzi jako gazowy .
Indeks górny Atkins P., Jones L., Chemia ogólna, Warszawa 2004, s. 116. Indeks górny koniecAtkins P., Jones L., Chemia ogólna, Warszawa 2004, s. 116.
Na podstawie powyższego opisu uzupełnij w równaniu reakcji informację o stanie skupienia reagentów, przeciągając odpowiednio (s), (aq), (g).
Zaprojektuj doświadczenie, w wyniku którego otrzymasz jodowodór.
Przedstaw schemat doświadczenia.
Podaj nazwy i wzory odczynników, których użyjesz w doświadczeniu.
Zapisz obserwacje.
Zapisz wnioski, w tym równanie zachodzącej reakcji chemicznej.
Schemat doświadczenia lub opis:
Odczynniki chemiczne:
Obserwacje:
Wnioski:
Równanie reakcji chemicznej:
