Sprawdź się
Przeanalizuj opis doświadczenia. Na jego podstawie zapisz obserwacje, wniosek, równanie reakcji, a także wskaż czynnik przyspieszający reakcję.
Przeprowadzono doświadczenie. W tym celu przygotowano dwie probówki, w których znajdowały się takie same ilości węglanu magnezu i kwasu solnego. Probówki zamknięto korkami, a jedną z nich włożono do gorącej wody. Po krótkim czasie, korek z ogrzewanej probówki został wystrzelony. Korek z probówki nie ogrzewanej został wyrzucony w późniejszym czasie.
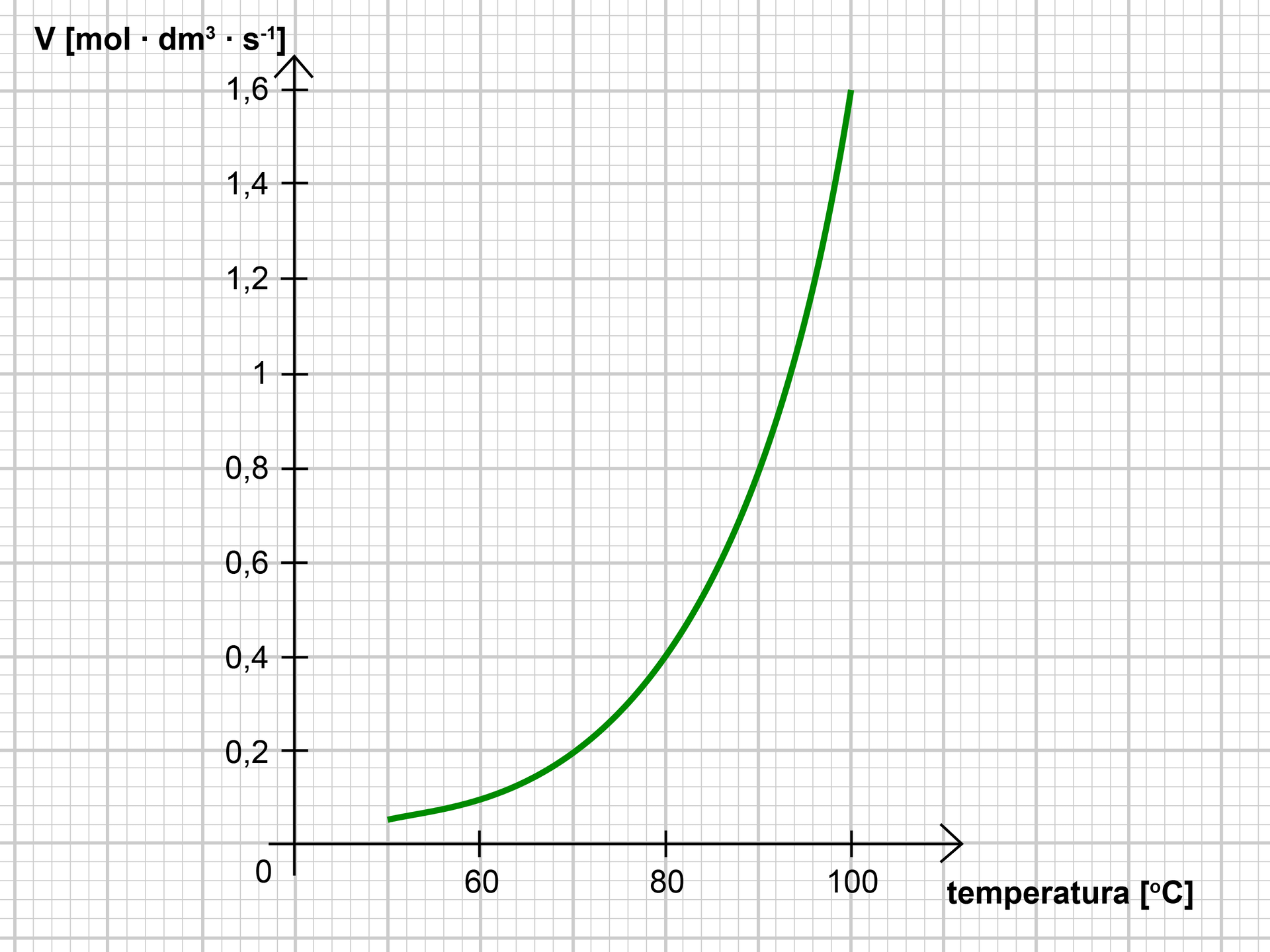
W temperaturze szybkość danej reakcji chemicznej wynosi . Sporządź wykres zależności szybkości reakcji od temperatury (w zakresie temperatur od do ), jeżeli podwyższenie temperatury o wywołuje dwukrotny wzrost szybkości reakcji.
W temperaturze szybkość danej reakcji chemicznej wynosi . Podaj współrzędne kilku punktów należących do wykresu zależności szybkości reakcji od temperatury (w zakresie temperatur od do ), jeżeli podwyższenie temperatury o wywołuje dwukrotny wzrost szybkości reakcji.
Podczas zajęć studenci przeprowadzili doświadczenie, które zilustrowano poniższym rysunkiem:
Podczas zajęć studenci przeprowadzili doświadczenie. Zapoznaj się z opisem ilustracji.

Studenci zauważyli, że w probówce nr gaz wydzielił się intensywniej niż w probówce nr .
Na podstawie podanych informacji napisz, jaki czynnik i w jaki sposób wpłynął na szybkość obserwowanych reakcji.
Wyjaśnij, dlaczego wzrost temperatury powoduje wzrost szybkości reakcji chemicznej.
Mając do dyspozycji dwie probówki, rozcieńczony kwas chlorowodorowy, stężony kwas chlorowodorowy, wstążkę magnezową, lód oraz gorącą wodę, zaprojektuj doświadczenie przedstawiające wpływ temperatury na szybkość reakcji chemicznej. Zanotuj obserwacje, wnioski oraz, jeśli to możliwe, równania zachodzących reakcji chemicznych.