Symulacja interaktywna
Czy zastanawiasz się czasami, w jaki sposób temperatura wpływa na szybkość przebiegu niektórych reakcji? W poniższym doświadczeniu przedstawiono reakcję kwasu szczawiowego z manganianem() potasu w obecności kwasu siarkowego().
Zanotuj czas trwania tej reakcji w określonych temperaturach, a następnie wykonaj ćwiczenia zamieszczone pod symulacją.
Czy zastanawiasz się czasami, w jaki sposób temperatura wpływa na szybkość przebiegu niektórych reakcji? Zapoznaj się z opisem symulacji, w której przedstawiono reakcję kwasu szczawiowego z manganianem() potasu w obecności kwasu siarkowego(), prowadzoną w różnych, określonych temperaturach. Następnie rozwiąż dołączone zadania.
Uwaga: Analizowana reakcja jest tzw. reakcją autokatalityczną, a więc taką, w której rolę katalizatora pełni jeden z powstających w jej wyniku produktów. W rozpatrywanej reakcji rolę katalizatora pełnią jony manganu(). Początkowo, kiedy w układzie nie ma jonów , reakcja ta przebiega powoli, ale kiedy w układzie pojawią się wspomniane jony, szybkość reakcji zwiększa się.
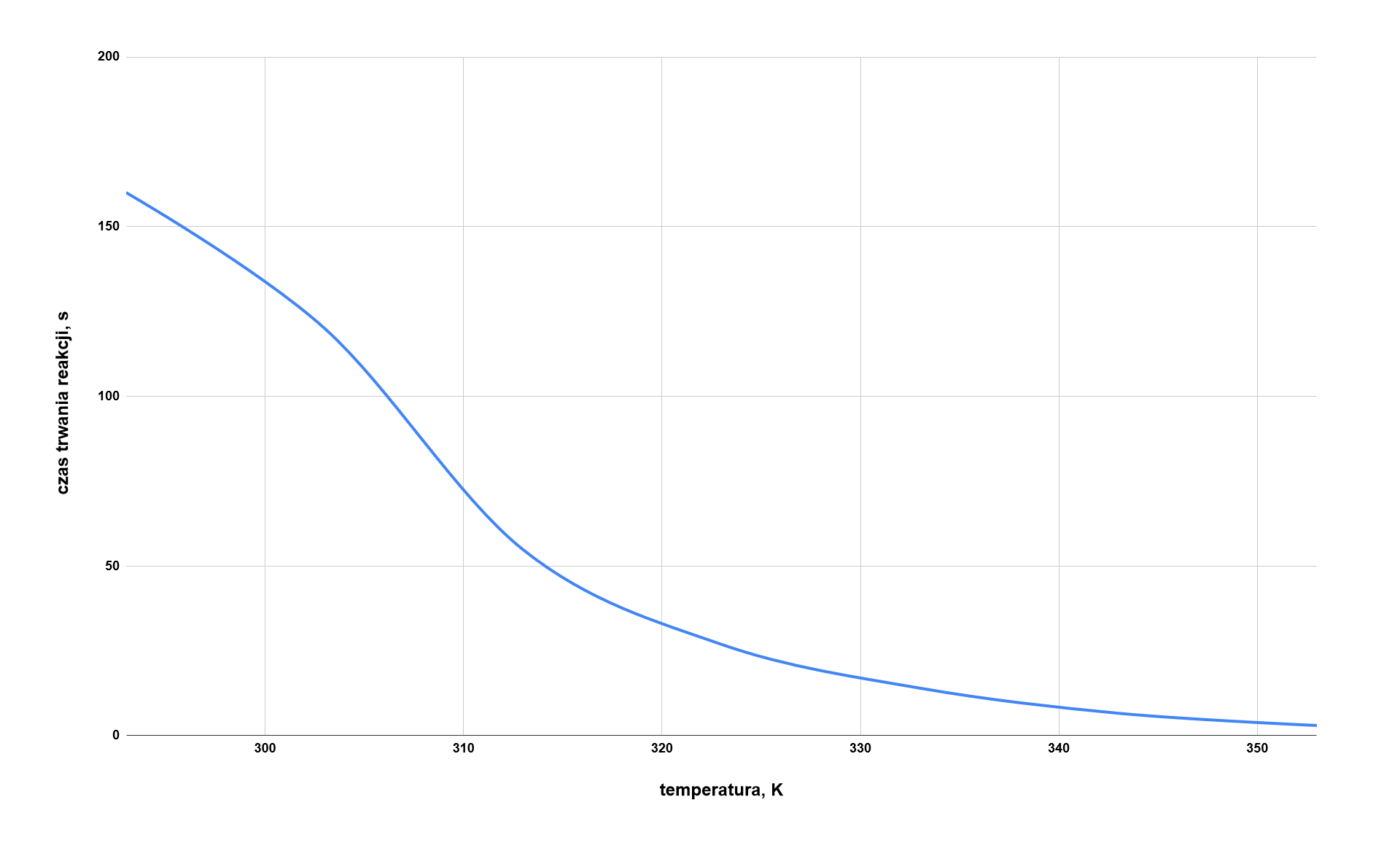
Wyniki doświadczenia
Temperatura | Czas trwania reakcji |
|---|---|
Uzupełnij poniższą tabelę wpisując w puste rubryki czas trwania analizowanej reakcji we wskazanych temperaturach. Następnie narysuj wykres zależności czasu trwania reakcji od temperatury. Temperaturę wyraź w kelwinach.
Na podstawie analizy wykresu ustal w jaki sposób temperatura wpływa na szybkość reakcji kwasu szczawiowego z manganianem() potasu w środowisku kwasowym.
Wykorzystując odpowiednie dane dotyczące czasu trwania analizowanej reakcji w temperaturach od do , wyznacz temperaturowy współczynnik szybkości reakcji (). Wynik zaokrąglij do liczby całkowitej.
Następnie odpowiedz na pytanie, w jaki sposób określona zmiana temperatury wpływa na szybkość reakcji kwasu szczawiowego z manganianem() potasu w środowisku kwasowym.
Stosując tzw. zapis jonowy skrócony, napisz równanie reakcji analizowanej w symulacji. Współczynniki stechiometryczne dobierz za pomocą bilansu jonowo‑elektronowego, z uwzględnieniem oddawanych lub pobieranych elektronów.