Przeczytaj
Większa część produktów spożywczych psuje się szybciej, kiedy temperatura otoczenia jest wyższa od temperatury pokojowej. Związane jest to z procesami biochemicznymi, jakie zachodzą w żywności. W temperaturze procesy te zachodzą dużo szybciej niż w temperaturze . Chłodzenie opóźnia wzrost bakterii w produktach spożywczych poprzez zmniejszenie szybkości reakcji biochemicznych, które umożliwiają bakteriom namnażanie się.
Podobnie jest w chemii – reakcje chemiczne zachodzą szybciej w podwyższonej temperaturze. Zależność temperaturową określa reguła van’t Hoffa. Jego doświadczenie udowodniło, że przy wzroście temperatury , szybkość reakcjiszybkość reakcji rośnie od dwóch do czterech razy i maleje tyle samo razy po obniżeniu temperatury o .
gdzie:
;
– szybkość reakcji przebiegającej w temperaturze ;
– szybkość reakcji przebiegającej w temperaturze ;
– współczynnik temperaturowy.
Reguła ta ma jednak charakter przybliżony – czasami stwierdza się odchylenia. Wartość współczynnika temperaturowego może być przyjęta za stałą tylko w określonym przedziale temperatur.
W 1889 r. szereg badań, analizujących wpływ temperatury na szybkość reakcji, przeprowadził Svante Arrhenius [arẹ:niüs]. Na podstawie wcześniejszych badań van’t Hoffa i analiz doświadczalnych, opracował równanie, które określa zmianę wartości stałej szybkości reakcji od temperatury. Równanie to jest nazwane równaniem Arrheniusa i przyjmuje postać:
– funkcja logarytmufunkcja logarytmu naturalnego;
– stała szybkości reakcji chemicznej;
– czynnik przedwykładniczy (czynnik częstości zderzeń);
– energia aktywacji reakcji chemicznej ;
– stała gazowa ;
– temperatura .
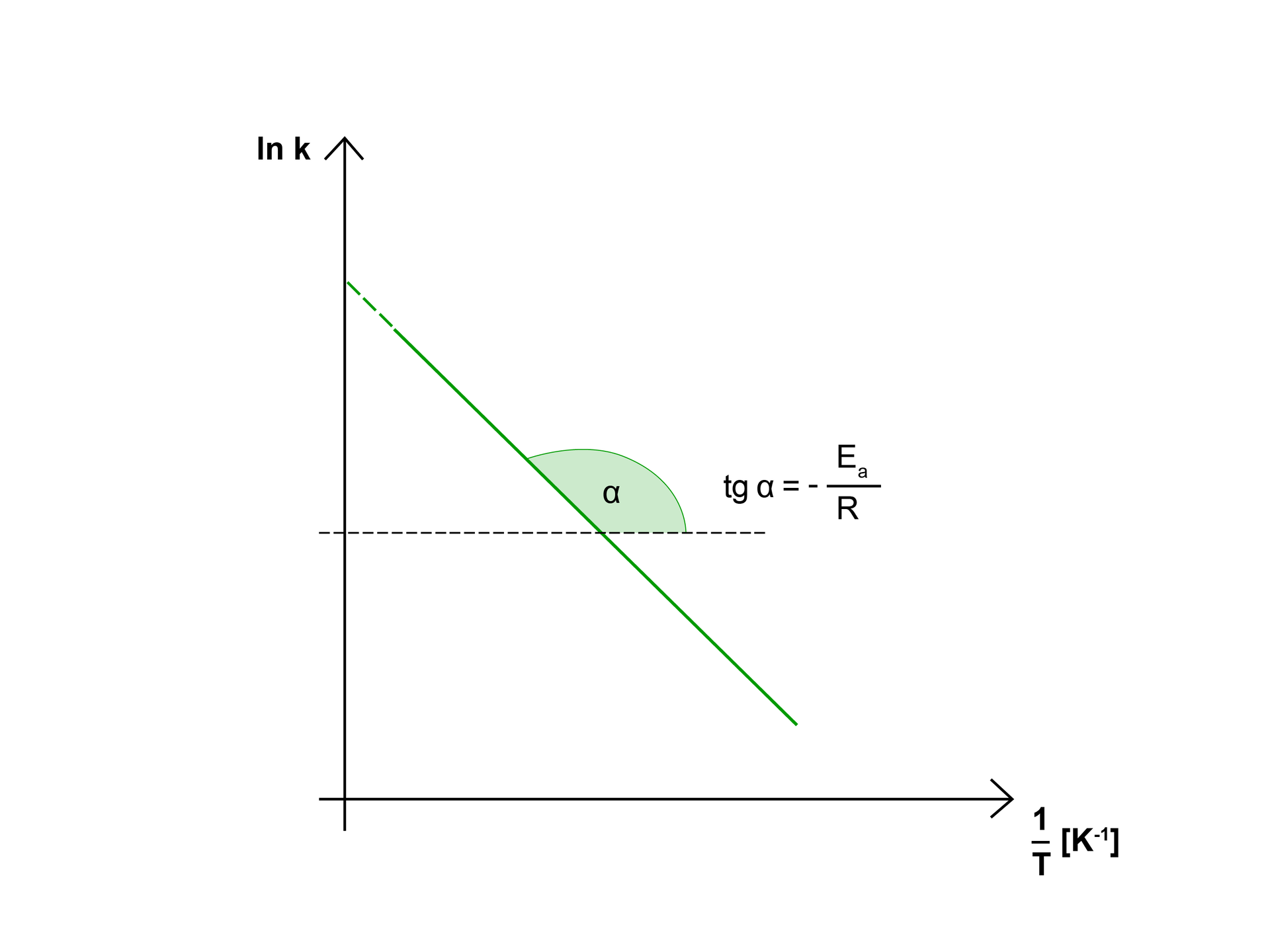
Wykres przedstawia zależność logarytmu stałej szybkości reakcji od odwrotności temperatury, w której została wyznaczona stała. Otrzymana linia prosta posiada charakterystyczne dla danej reakcji nachylenie. Nachylenie linii jest równe , a punkt przecięcia z osią rzędnych wyznacza wartość lnA. Z wykresów tego typu można więc wyznaczyć doświadczalne wartości energii aktywacji () oraz czynnik częstości zderzeń (). Obie te wielkości noszą wspólną nazwę – parametry Arrheniusa.
Na podstawie powyższego wykresu można stwierdzić kilka zależności, które są przydatne w praktyce.
Im energia aktywacjienergia aktywacji jest większa, tym trudniej zainicjować reakcję.
Jeśli energia aktywacji jest wysoka, reakcja przede wszystkim zależy od temperatury, więc do zapoczątkowania jej przebiegu wymagana jest znaczna ilość ciepła.
Jeśli energia aktywacji jest niska, szybkość reakcji wzrasta nieznacznie wraz z temperaturą, a reakcje te przebiegają ze znaczną szybkością w normalnych warunkach.
Jeżeli energia aktywacji jest równa zeru, oznacza to, że szybkość reakcji jest niezależna od temperatury.
Przewidywania tego typu są ważne np. w kontrolowaniu reakcji przemysłowych w celu zapobiegania potencjalnym katastrofom.
Teoria zderzeń
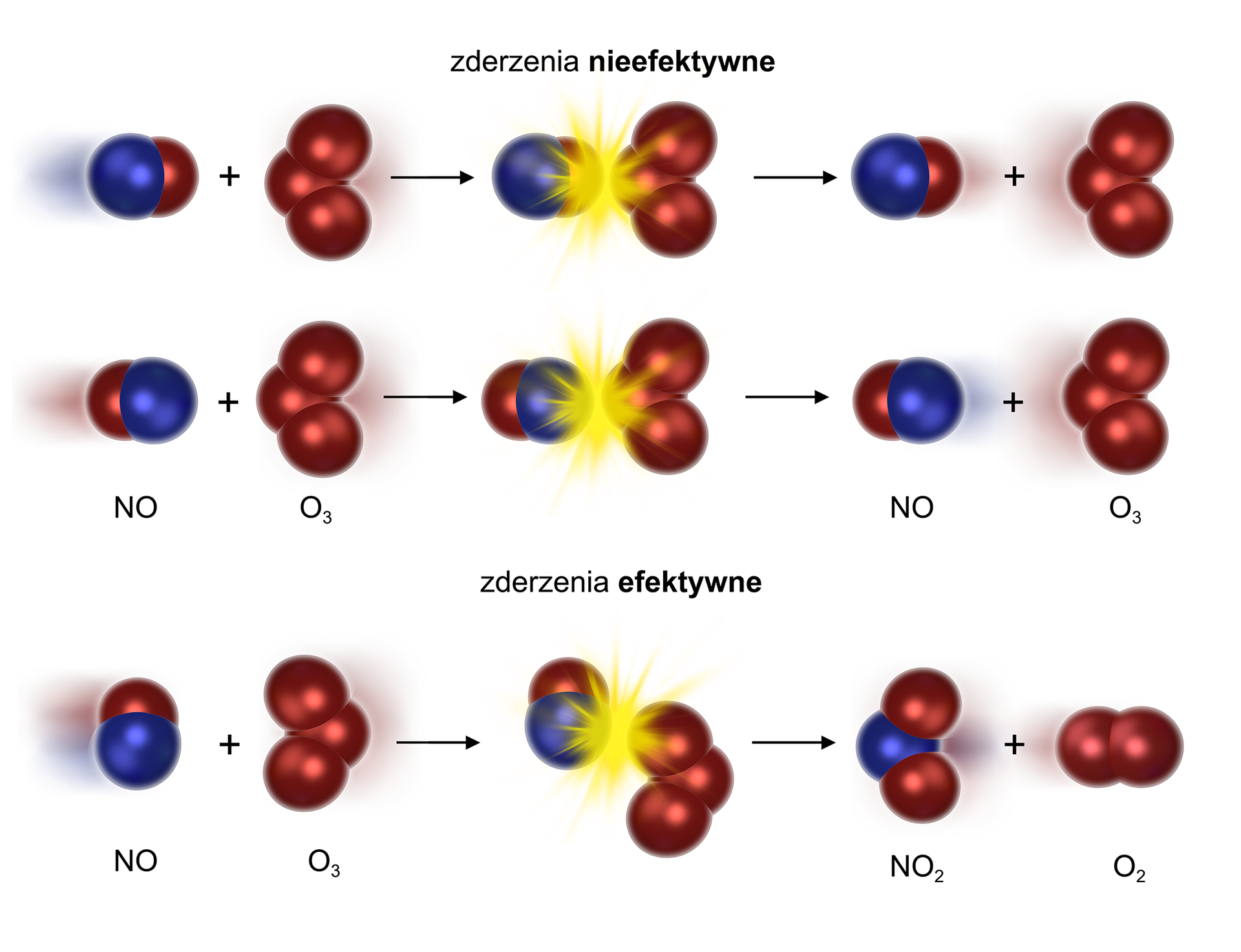
Zależność wzrostu szybkości reakcji pod wpływem temperatury jest związana z teorią zderzeńteorią zderzeń. Odnosi się ona do reakcji chemicznych, zachodzących w fazie gazowej. Zgodnie z nią indywidua chemiczne (atomy/cząsteczki/jony) reagują ze sobą, kiedy się zderzają, a reakcja zachodzi tylko wtedy, gdy zderzające się indywidua posiadają energię kinetyczną przynajmniej równą energii aktywacji.
Tę teorię można porównać do zderzenia dwóch kul bilardowych. Gdy energia zderzenia jest niewielka, wówczas kule (czyli indywidua chemiczne) odbijają się od siebie (zderzenie nieefektywne). Jednak gdy ta energia przekroczy pewną wartość minimalną, kule mogą się roztrzaskać (wtedy powstają produkty), co w efekcie zaprowadzi do zajścia reakcji chemicznej (zderzenia efektywnego). Proces ten został zobrazowany na poniższym rysunku.
Teoria kompleksu aktywnego
Drugą, bardziej zaawansowaną teorią tłumaczącą wzrost szybkości reakcji, jest teoria kompleksu aktywnegokompleksu aktywnego. Odnosi się ona zarówno do reakcji w roztworach, jak i w fazie gazowej. Na jej podstawie wiemy, że dwa indywidua, które zbliżają się do siebie, w momencie spotkania ulegają odkształceniu. Ich zderzenie może doprowadzić do utworzenia nietrwałego przejściowego układu, zwanego kompleksem aktywnym (można go przedstawić jako zespół atomów). Z kolei kompleks aktywny może przekształcić się w produkty lub rozpaść się na wyjściowe substraty.

Podczas wzrostu temperatury układu, wzrasta również średnia energia kinetyczna każdego ze składników. To powoduje, że indywidua poruszają się szybciej, dzięki czemu mają więcej energii przy każdym zderzeniu. Dodatkowo, szybciej poruszające się cząsteczki częściej zderzają się ze sobą w określonym czasie. Wzrost aktywności oraz energii powoduj szybsze zajście reakcji, a co za tym idzie – szybsze powstanie produktu końcowego. Szybkość praktycznie wszystkich reakcji rośnie wraz ze wzrostem temperatury. I odwrotnie: szybkość prawie wszystkich reakcji zmniejsza się wraz ze spadkiem temperatury.
Jak temperatura wpływa na szybkość oddychania w drożdżach?
Drożdże są używane do produkcji chleba, ponieważ oddziałują na jego wzrost. Dzięki nim dochodzi do fermentacji cukru, a w wyniku zachodzącej reakcji powstaje tlenek węgla(IV). Gdy temperatura jest podwyższona, reakcja ta zachodzi szybciej. Wzrost temperatury zwiększa tempo przemiany biochemicznej w drożdżach. Można to zobaczyć, jeśli się umieści ciepłą wodę w probówce, dodając do niej drożdże i mierząc wzrost ciśnienia (np. używając balonu – po kilku minutach można zauważyć napełnianie balonu).
Proces ten jest wykorzystywany w przemyśle nie tylko do produkcji pieczywa, ale również do piwa czy wina.

Wykonaj doświadczenie, w którym zbadasz zależności szybkości procesu rozpuszczania od temperatury. Zanotuj obserwacje oraz wnioski.
Przygotuj:
trzy probówki;
sól kuchenną (nazwa systematyczna chlorek sodu, );
zimną wodę;
wodę o temperaturze pokojowej;
gorącą wodę.
Instrukcja: do pierwszej probówki dodaj zimną wodę, do drugiej wodę w temperaturze pokojowej, a do trzeciej gorącą. Do każdej z nich wsyp taką samą ilość soli kuchennej.
Analizując ukazane przykłady, łatwo można stwierdzić, że zarówno w życiu codziennym, jak i w chemii, temperatura ma ogromny wpływ na przebieg reakcji chemicznych, czy – jak w przypadku rozpuszczalności – także procesów fizycznych. Kiedy jest wyższa, reakcje przebiegają szybciej, a kiedy niższa, tempo reakcji maleje.
Słownik
zmiana stężenia reagentów (substratów lub produktów) w jednostce czasu
substancja, która zmienia szybkość reakcji chemicznej, nie naruszając stanu końcowej równowagi i właściwości termodynamicznych układu i pozostając w stanie niezmienionym po zakończeniu reakcji
układ jąder i elektronów; powstaje wskutek zderzenia cząsteczek substratów; stanowi stan przejściowy, przez który przebiega reakcja chemiczna na drodze od substratów do produktów
minimalna ilość energii, którą muszą mieć indywidua chemiczne (cząsteczki, atomy, jony), aby mogła zajść między nimi reakcja chemiczna
teoria pochodząca z zakresu chemii fizycznej. Teoria ta zakłada, iż reakcje chemiczne zachodzą w wyniku zderzeń cząsteczek zdolnych do reagowania ze sobą
funkcja, której wartość otrzymuje się obliczając logarytm dla zmiennej niezależnej
oddychanie komórkowe, utlenianie biologiczne; zachodzące w żywych komórkach procesy rozkładu różnych substancji organicznych, dostarczające niezbędnej do życia energii
Bibliografia
Atkins A., Jones L., Chemical Principles: The Quest for Insight, New York 2009, wyd. 5.
Bieniek G., Doświadczenia chemiczne w zadaniach, Kraków 2007.
Encyklopedia PWN
Jacewicz D., Wyrzykowski D., Kinetyka i termodynamika związków koordynacyjnych, Gdańsk 2016, online: https://chemia.ug.edu.pl/sites/default/files/_nodes/strona-chemia/16683/files/kinet_termod_2013uz_0.pdf, dostęp: 17.02.2021.
Penkala T., Podstawy Chemii Ogólnej, Warszawa 1982.