Sprawdź się
Pokaż ćwiczenia:
Ćwiczenie 1
Ćwiczenie 1
Ćwiczenie 2
Źródło: Englishsquare.pl Sp. z o.o., licencja: CC BY-SA 3.0.
Ćwiczenie 2
Ćwiczenie 3
Ćwiczenie 4
Poniższa ilustracja przedstawia mechanizm degradacji białek na szlaku ubikwityna–proteasom.
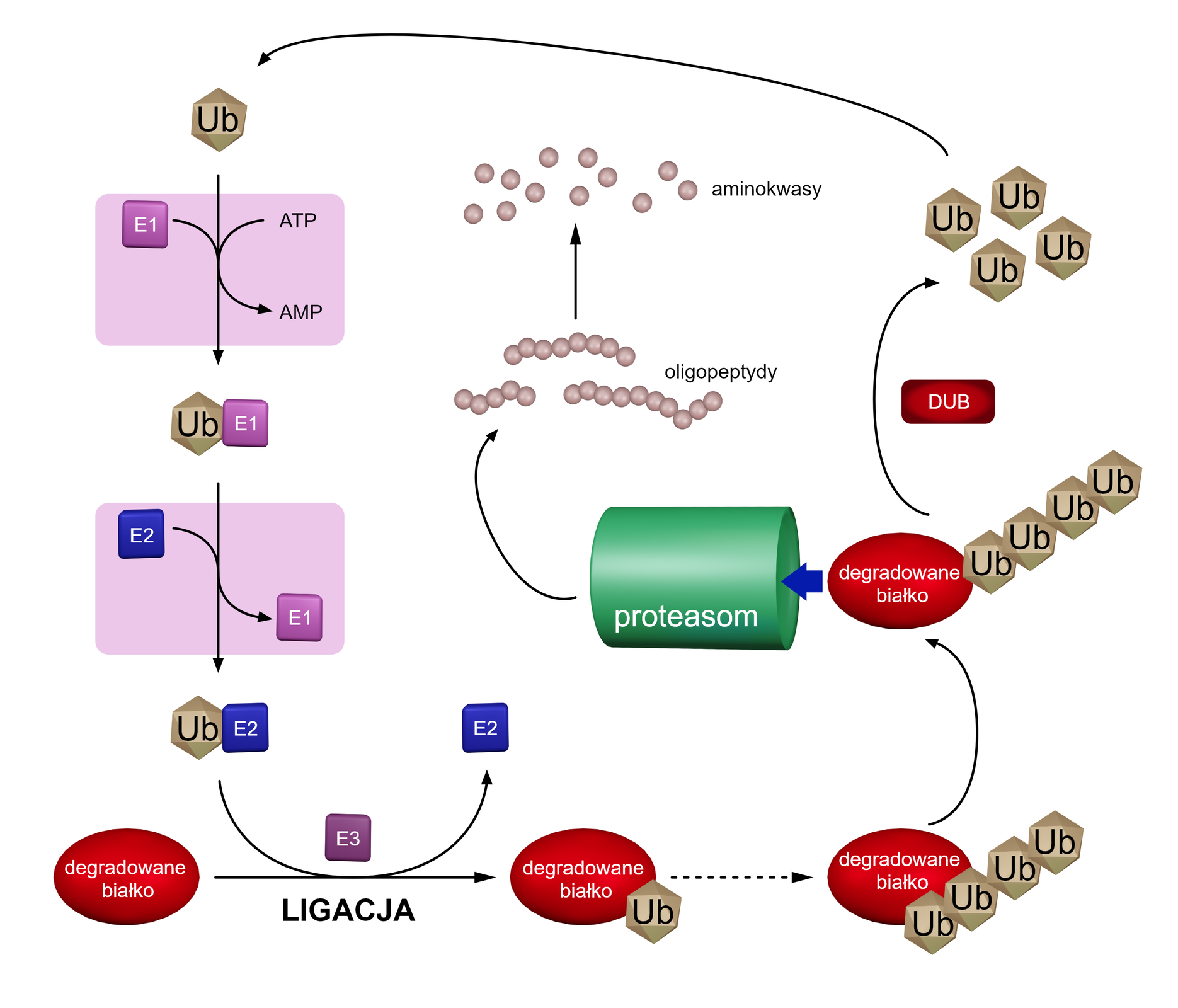
Mechanizm degradacji białek na szlaku ubikwityna–proteasom.
Legenda: :
- DUB (ang. deubiquitinatig enzymes) – enzymy deubikwitynujące, czyli odwracające reakcję ubikwitynacji;
- Ub – ubikwityna;
- E1, E2, E3 – enzymy uczestniczące w procesie ubikwitynacji, kanalizujące trzy kolejne etapy.
Legenda: :
- DUB (ang. deubiquitinatig enzymes) – enzymy deubikwitynujące, czyli odwracające reakcję ubikwitynacji;
- Ub – ubikwityna;
- E1, E2, E3 – enzymy uczestniczące w procesie ubikwitynacji, kanalizujące trzy kolejne etapy.
Źródło: Englishsquare.pl Sp. z o.o., licencja: CC BY-SA 3.0.
Ćwiczenie 4
Ćwiczenie 5
Przyczyną zmian chorobowych jest... Możliwe odpowiedzi: 1. zablokowanie centrum katalitycznego rdzenia proteasomu., 2. niszczenie nieprawidłowych białek przez proteasomy., 3. zablokowanie regulatorów proteasomów., 4. niezdolność proteasomów do rozkładu nieprawidłowych białek.
Ćwiczenie 6
Część aktywną katalitycznie proteasomu 26S stanowi rdzeń składający się na proteasom 20S.
Ćwiczenie 7
Proteasomy degradują m.in. białka regulujące cykl komórkowy, apoptozę (zaprogramowaną genetycznie śmierć komórki), ekspresję genów. Wzrost ekspresji i aktywności proteasomów prowadzi do wzrostu liczby komórek nowotworowych i ich odporności na chemioterapię.
Ćwiczenie 8
Proteazy proteasomu tną w wielu miejscach długie łańcuchy polipeptydowe na krótkie oligopeptydy, zbudowane z 3–25 reszt aminokwasowych, a lizosomalne proteazy rozcinają łańcuchy polipeptydowe na 2 krótsze.