Sprawdź się
Pokaż ćwiczenia:
Ćwiczenie 1
Ćwiczenie 2
Poniższy proces przedstawia:

Źródło: GroMar Sp. z o.o., licencja: CC BY-SA 3.0.
Ćwiczenie 3
Ćwiczenie 4
Poniższa reakcja jest przykładem reakcji:
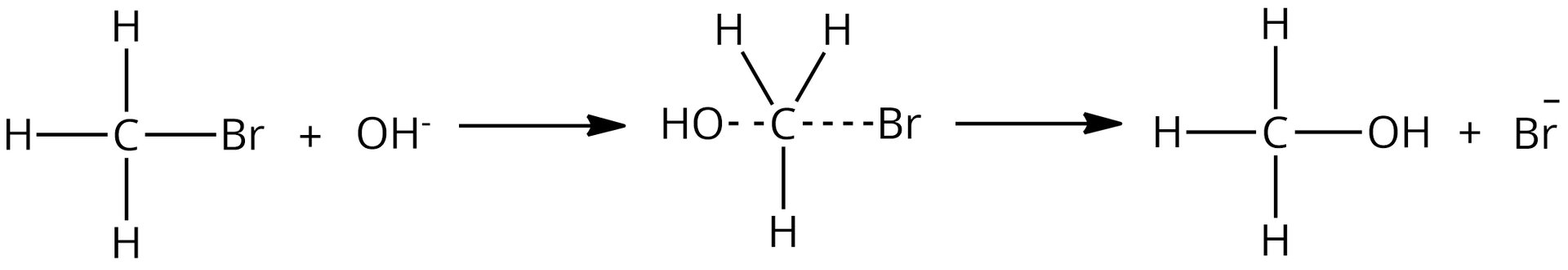
Źródło: GroMar Sp. z o.o., licencja: CC BY-SA 3.0.
Ćwiczenie 5
Poukładaj puzzle, wiedząc, że pierwszy przedstawiony proces to heteroliza.
Źródło: GroMar Sp. z o.o., licencja: CC BY-SA 3.0.
Ćwiczenie 6
W poniższej reakcji wskaż zasadę oraz kwas Lewisa.
Źródło: GroMar Sp. z o.o., licencja: CC BY-SA 3.0.
Ćwiczenie 7
Ćwiczenie 8
Dokończ poniższą reakcję.
Źródło: GroMar Sp. z o.o., licencja: CC BY-SA 3.0.
Ćwiczenie 8
Jeśli wspólna para elektronowa, która tworzy wiązanie kowalencyjne, ulega rozerwaniu w taki sposób, że przy każdym z fragmentów pozostaje jeden elektron niesparowany, wtedy ów rozpad nazywamy rozpadem 1. homolityczne, 2. homolitycznym, 3. hamujących, 4. inicjujących, 5. heterolityczne, 6. jony, 7. heterolitycznym, 8. rodniki. W wyniku tego rozpadu powstają 1. homolityczne, 2. homolitycznym, 3. hamujących, 4. inicjujących, 5. heterolityczne, 6. jony, 7. heterolitycznym, 8. rodniki – reaktywne indywidua chemiczne, mogące pełnić rolę tzw. czynników atakujących (1. homolityczne, 2. homolitycznym, 3. hamujących, 4. inicjujących, 5. heterolityczne, 6. jony, 7. heterolitycznym, 8. rodniki) w dalszych etapach przemiany chemicznej.

