Sprawdź się
Entalpia rozpuszczania octanu kwasu salicylowego w wodzie wynosi . Określ, czy rozpuszczanie octanu kwasu salicylowego to proces egzotermiczny, czy endotermiczny.
Dokończ poprawnie zdanie.
Po wprowadzeniu amoniaku do wody, stwierdzono, że mieszanina się ochłodziła. Świadczy to o tym, że entalpia rozpuszczania ΔHr jest: {#większa od zera} {mniejsza od zera} {równa zero}.
Poniżej przedstawiono efekt energetyczny towarzyszący procesowi rozpuszczania różnych substancji nieorganicznych. Znak „” oznacza efekt endotermiczny, a znak „” efekt egzotermiczny.
Zaznacz w tabeli, które związki chemiczne, wprowadzone do wody, spowodują wzrost temperatury.
| Substancja | Efekt energetyczny podczas rozpuszczania w wodzie | Wzrost temperatury |
| NaOH | - | □ |
| KOH | - | □ |
| Ca(OH)2 | - | □ |
| AgNO3 | + | □ |
| Al2(SO4)3 | - | □ |
| BaCl2 | - | □ |
| KCl | + | □ |
| MgSO4 | - | □ |
| NaNO3 | + | □ |
| NH4Cl | + | □ |
| NH3 | - | □ |
| HCl | - | □ |
| H2O2 | - | □ |
| H2SO4 | - | □ |
| H2S | - | □ |
Dokończ poniższe zdanie.
solwatacji, otaczania, Solwatacja, Adsorpcja, rozpuszczania, do, dostarczanie energii z, oddawanie energii z, z, Absorpcja
............................................ to proces otaczania jonów rozpuszczanego związku chemicznego przez cząsteczki rozpuszczalnika. Temu procesowi towarzyszy ............................................ układu ............................................ otoczenia. Energię tę nazywamy energią ............................................ i oznaczamy symbolem ΔHsolw.
Hydraty to sole nieorganiczne, które w sieci krystalicznej zawierają uwięzione cząsteczki wody. Ilość zhydratowanych cząsteczek wody wpływa na entalpię rozpuszczania tych soli, ponieważ zmienia się jej stężenie. Wraz ze wzrostem ilości cząsteczek wody w sieci krystalicznej, układ dąży coraz bardziej do przyjmowania energii od otoczenia, a nie jej oddawania.
Dopasuj wartości entalpii rozpuszczania do danego hydratu siarczanu() magnezu, przenosząc je w wyznaczone miejsca w tabeli.
MgSO4 · H2O, MgSO4 · 2 H2O, MgSO4 · 4 H2O, MgSO4 · 6 H2O, MgSO4 · 7 H2O
| Wzór hydratu | Entalpia rozpuszczania |
|---|---|
| MgSO4 · H2O | |
| MgSO4 · 2 H2O | |
| MgSO4 · 4 H2O | |
| MgSO4 · 6 H2O | |
| MgSO4 · 7 H2O |
Do dwóch probówek wlano wodę destylowaną o temperaturze , a następnie wsypano odpowiednio do pierwszej – kwas szczawiowy, a do drugiej – octan amonu. Określ, w której z probówek wzrosła temperatura do , jeżeli wiesz, że (entalpia rozpuszczania) kwasu szczawiowego wynosi , a octanu amonu wynosi .
Rozpuszczaniu ciał stałych w wodzie może towarzyszyć wydzielanie lub pochłanianie energii cieplnej. Przeprowadzono doświadczenie zilustrowane na poniższym schemacie:
Rozpuszczaniu ciał stałych w wodzie może towarzyszyć wydzielanie lub pochłanianie energii cieplnej. Przeprowadzono doświadczenie. Zapoznaj się z jego opisem.
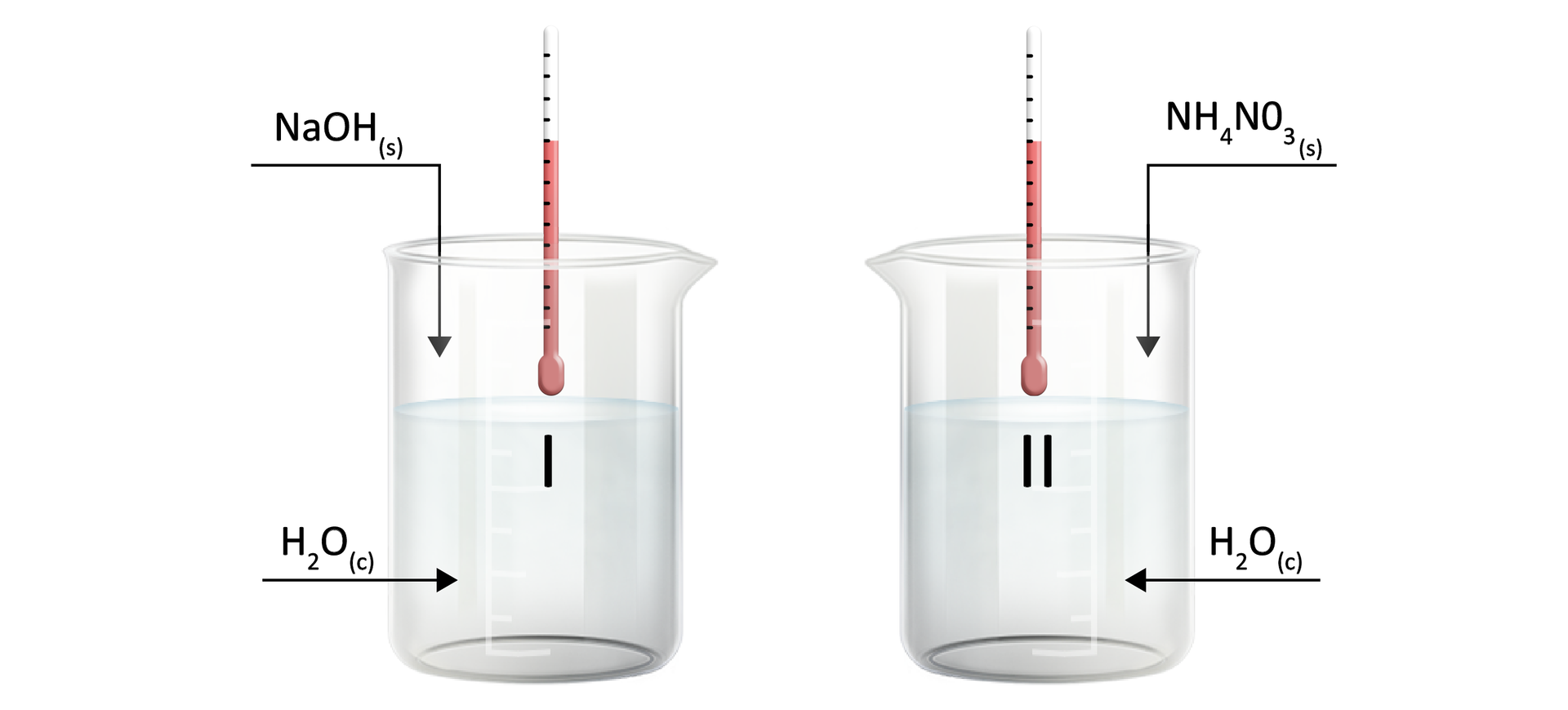
Poniższa tabela obrazuje wartości temperatur odczytane z termometru przed i po wykonaniu doświadczenia.
Uzupełnij tabelę, przenosząc prawidłowe odpowiedzi, związane z obserwowanymi zmianami temperatury w czasie rozpuszczania ciał stałych w wodzie.
I, II
| Probówka | Proces rozpuszczania jest... | Entalpia |
|---|---|---|
| I | ||
| II |
Proces rozpuszczania krystalicznych substancji stałych można ująć za pomocą schematu:
Proces rozpuszczania krystalicznych substancji stałych można ująć za pomocą schematu. Zapoznaj się z jego opisem.

– sumaryczna entalpia procesu rozpuszczania,
– energia sieci krystalicznej,
– entalpia solwatacji.
Wybierz zależności spośród następujących, a następnie wstaw je w wykropkowane pola tak, aby powyższe zdania były zgodne ze schematem.
1. Zniszczenie struktury kryształu 1. , 2. , 3. , 4. .
2. Przeniesienie tak powstałych cząstek do rozpuszczalnika i ich solwatacja z udziałem rozpuszczalnika 1. , 2. , 3. , 4. .
A B, B C, C B, A C
Zgodnie ze schematem, proces rozpuszczania substancji A w B można rozdzielić na dwa etapy:
1. Zniszczenie struktury kryształu .................
2. Przeniesienie tak powstałych cząstek do rozpuszczalnika i ich solwatacja z udziałem rozpuszczalnika .................
Proces rozpuszczania krystalicznych substancji stałych można ująć za pomocą schematu:
Proces rozpuszczania krystalicznych substancji stałych można ująć za pomocą schematu. Zapoznaj się z jego opisem.
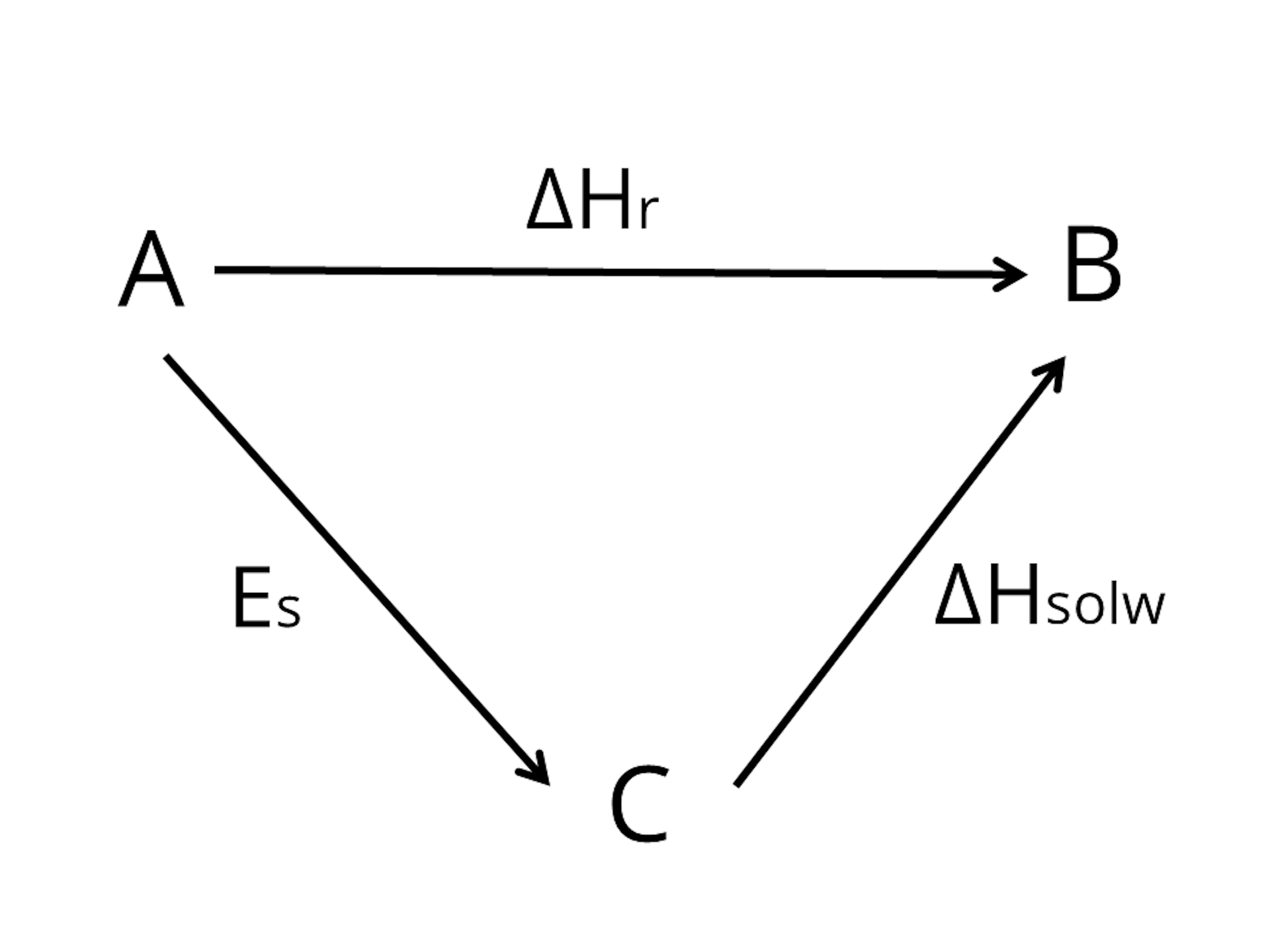
– sumaryczna entalpia procesu rozpuszczania,
– energia sieci krystalicznej,
– entalpia solwatacji.
Entalpia rozpuszczania jest równa sumie algebraicznej energii zniszczenia sieci krystalicznej (energii sieci krystalicznej) oraz entalpii solwatacji (entalpii solwatacji).
Efekt cieplny niszczenia sieci krystalicznej jest wielkością endotermiczną (pobiera ciepło z otoczenia), natomiast proces solwatacji (hydratacji) jest egzotermiczny, czyli przebiega z wydzielaniem ciepła.
Różnica tych wielkości decyduje, czy sumarycznie rozpuszczanie jest egzo-, czy endotermiczne.
Wiedząc, że dla sacharozy wynosi , określ, która z bezwzględnych wartości energii – energii sieci krystalicznej czy entalpii solwatacji – jest wielkością większą.