Sprawdź się
Pokaż ćwiczenia:
Ćwiczenie 1
Ćwiczenie 2
Połącz w pary pojęcia z odpowiednimi definicjami.
Ćwiczenie 3
W oparciu o teorię VSEPR określ kształt cząsteczki amoniaku.
Ćwiczenie 4
Opierając się na teorii VSEPR, omów budowę cząsteczki .
Ćwiczenie 5
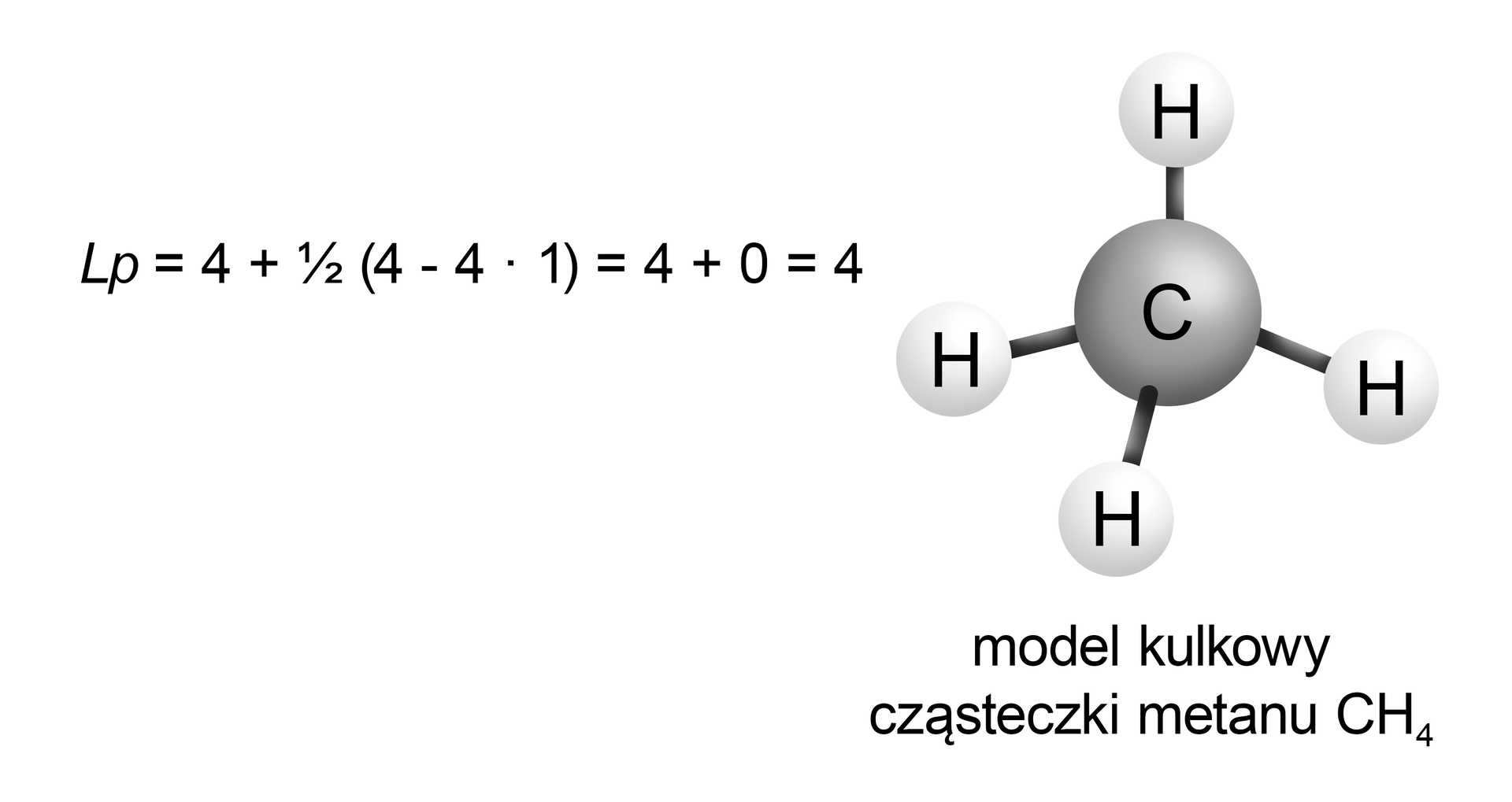
Stosując teorię VSEPR, oblicz liczbę orbitali zhybrydyzowanych dla najprostszego alkanu. Przedstaw model kulkowy tej cząsteczki.
Ćwiczenie 6
Dane są cząsteczki: , , , , . Odpowiedz na pytanie, w której cząsteczce kąt pomiędzy wiązaniami jest najbliższy ?
Ćwiczenie 7
Ćwiczenie 8
Ćwiczenie 9