Sprawdź się
Zaznacz prawidłowe określenia w podanym tekście.
Nukleofil to indywiduum molekularne, które „lubi” {#ładunek dodatni}{elektrony}. W cząsteczce nukleofila obecny jest atom {mający deficyt elektronów}{#mający nadmiar elektronów}, dzięki czemu może utworzyć wiązanie poprzez {#dostarczenie pary elektronowej}{akceptację pary elektronowej}. Nukleofile często są {#anionami}{kationami}, chociaż mogą być także cząsteczkami obojętnymi elektrycznie.
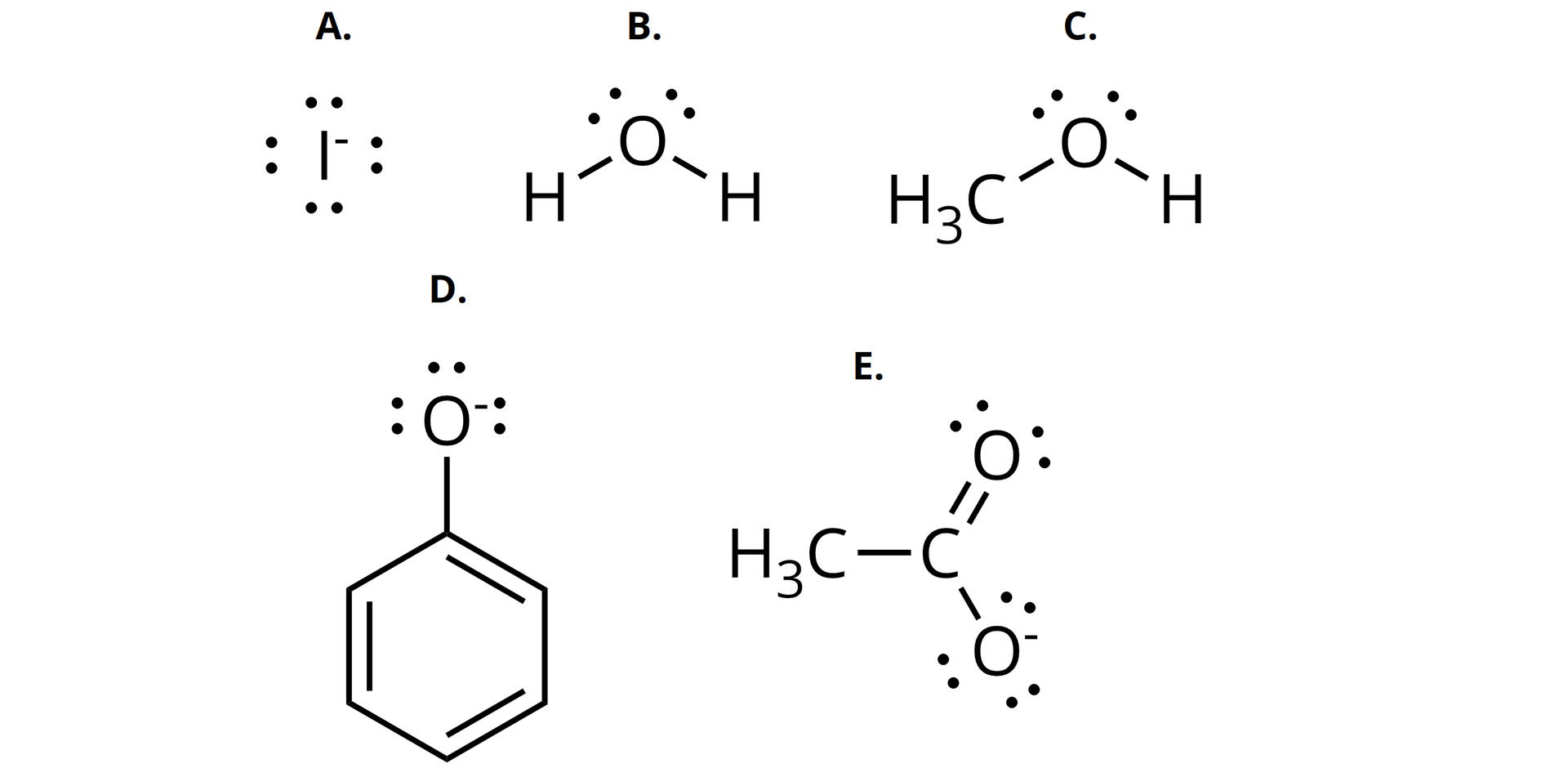
Dopasuj nazwy do wzorów podanych poniżej nukleofili.
Uzupełnij zdanie tak, aby uzyskać prawdziwą informację.
nukleofile, elektrofile
Zasady Lewisa są donorami elektronów i zachowują się jak ....................... Z kolei kwasy Lewisa są akceptorami elektronów i zachowują się jak ....................... Różnica polega na tym, że pojęć, takich jak elektrofil czy nukleofil, używa się wtedy, gdy mówimy o wiązaniu z atomem węgla.
Podaj liczbę wolnych par elektronowych, zawartych na atomach, które są nukleofilami w:
A., B., C., D., E., anionie jodkowym, cząsteczce wody, metanolu, anionie fenolanowym, anionie octanowym, 1, 1, 1, 2, 3, 4, 4
| Liczba wolnych par elektronowych | ||
|---|---|---|
| A. | anionie jodkowym | |
| B. | cząsteczce wody | |
| C. | metanolu | |
| D. | anionie fenolanowym | |
| E. | anionie octanowym |
Pewien nukleofil składa się z dwóch atomów dwóch różnych pierwiastków, połączonych wiązaniem. Atom o większej masie atomowej ma trzy wolne pary elektronowe, a w wyniku uwspólnienia elektronów, zyskuje konfigurację elektronową neonu. Atom o mniejszej masie atomowej, tworząc homoatomową cząsteczkę, występuje jako gaz o najmniejszej gęstości.
Podaj wzór sumaryczny i nazwę nukleofila, o którym mowa w treści zadania.
Przeczytaj poniższą informację.
Reakcja alkilowania Friedela‑Craftsa jest reakcją aromatycznej substytucji elektrofilowej, w której elektrofilem jest karbokation, RIndeks górny ++. Chlorek glinu katalizuje reakcję, ułatwiając jonizację halogenku:

Następnie para elektronowa z pierścienia aromatycznego atakuje karbokation, tworząc wiązanie C‑C oraz dając nowy karbokation pośredni. W kolejnym etapie utrata protonu daje obojętny produkt.
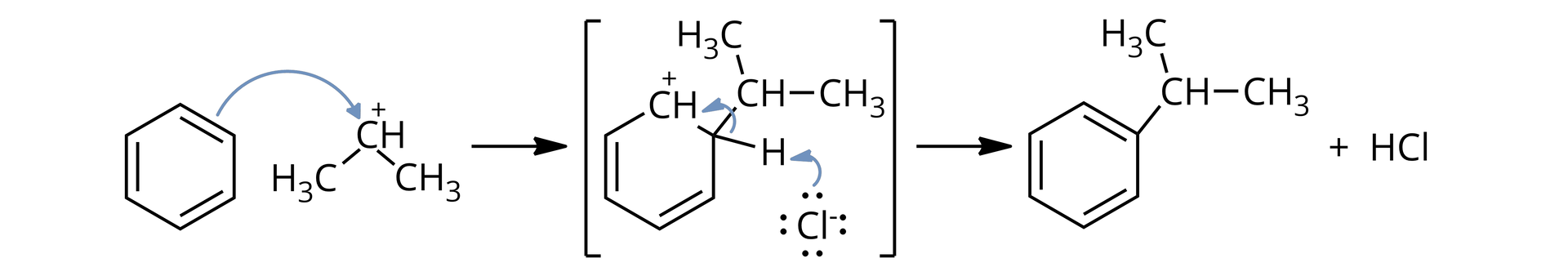
Indeks dolny McMurry J., Chemia organiczna, tłum. Henryk Koroniak i in., t.1, Warszawa 2018. Indeks dolny koniecMcMurry J., Chemia organiczna, tłum. Henryk Koroniak i in., t.1, Warszawa 2018.
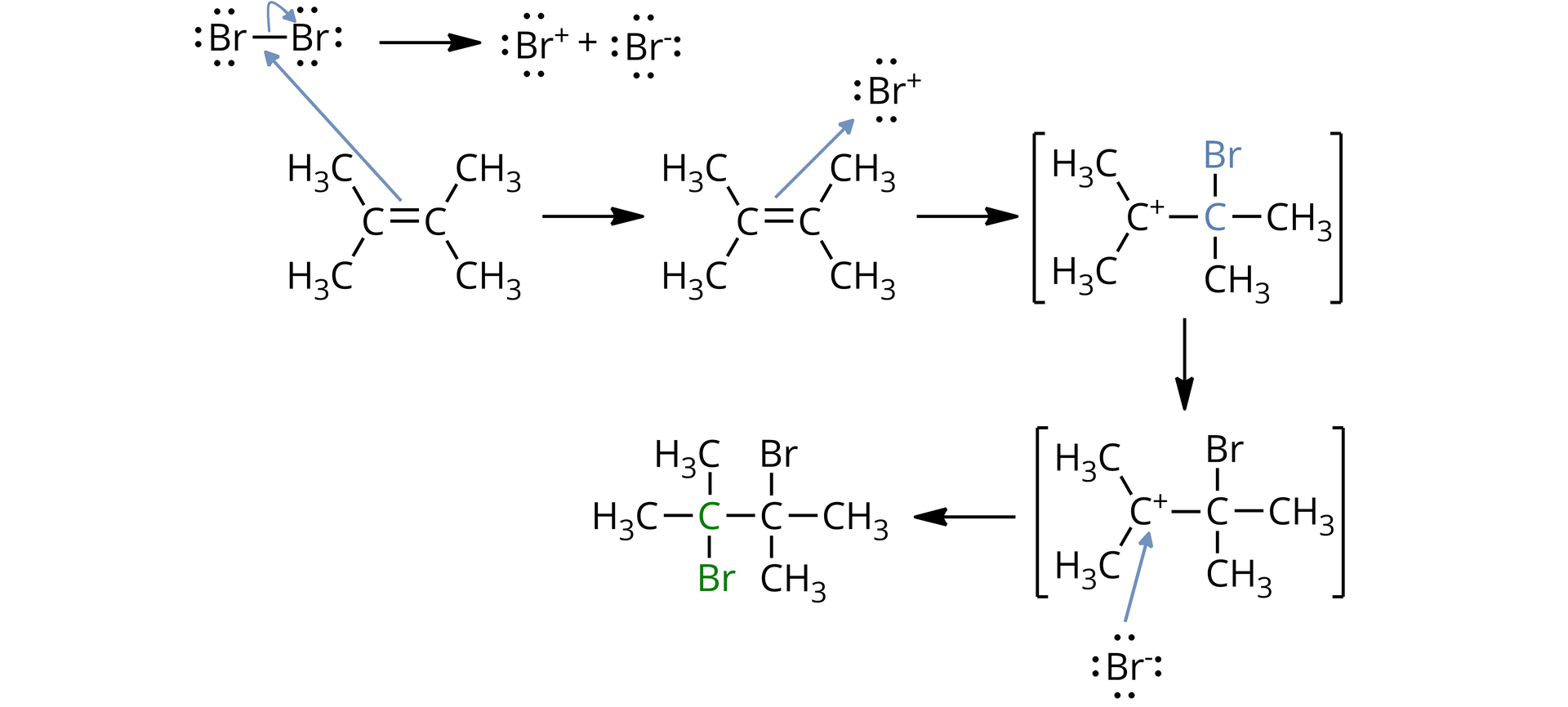
Poniżej przedstawiono mechanizm reakcji addycji elektrofilowej na przykładzie 2,3‑dimetylobut‑2-enu z .