Sprawdź się
Kwas fosforowy() jest elektrolitem średniej mocy, dysocjującym trójstopniowo. Stałe dysocjacji dla kolejnych etapów dysocjacji mają następujące wartości:
Napisz równania dysocjacji dla tego kwasu oraz podaj nazwy anionów tworzących się w kolejnych etapach dysocjacji.
Kwas fosforowy() jest elektrolitem średniej mocy dysocjującym trójstopniowo. Stałe dysocjacji dla kolejnych etapów dysocjacji mają następujące wartości:
W zlewce znajduje się wodny roztwór kwasu fosforowego(). Uporządkuj wszystkie jony, które występują w tym roztworze, wg malejącego stężenia molowego.
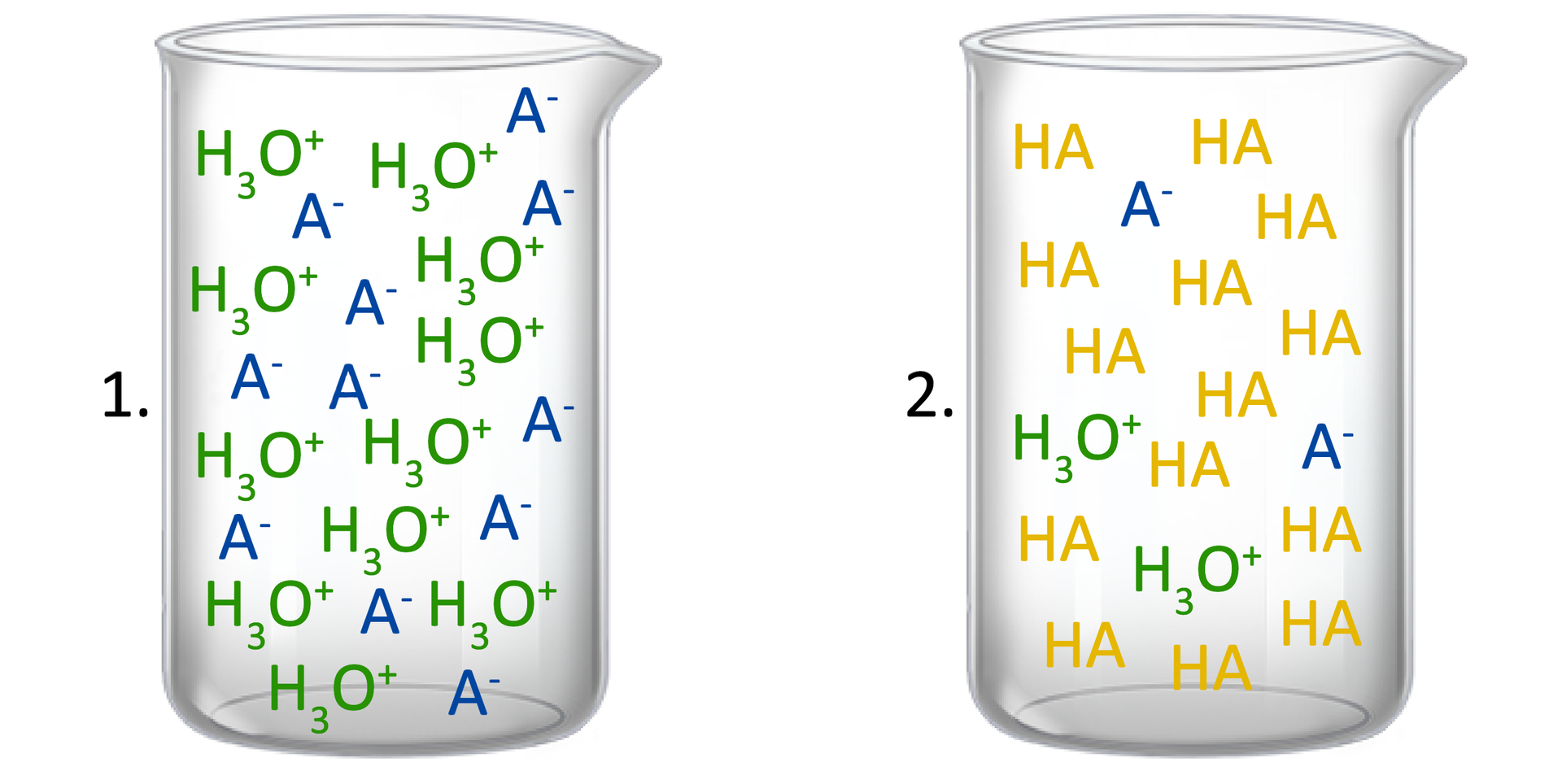
Określ, który schematyczny rysunek najlepiej przedstawia roztwór słabego kwasu o stałej dysocjacji i stężeniu molowym ? Odpowiedź uzasadnij.
Wartość kwasu octowego o stężeniu molowym wynosi . Oblicz stałą dysocjacji tego kwasu.
Oblicz, ile moli jonów pochodzi z dysocjacji soli w roztworu chlorku wapnia o stężeniu .
Oblicz wartość stałej dysocjacji kwasu typu , jeśli wiadomo, że roztwór o stężeniu ma równe .
Jakie jest stężenie amoniaku w wodzie, jeśli tego roztworu wynosi ? Stała dysocjacji dla wodnego roztworu amoniaku wynosi . Wynik podaj w jednostce z dokładnością do dwóch miejsc po przecinku.