Sprawdź się
Tabela Właściwości fizyczne wybranych węglowodorów i halogenopochodnych
Nazwa związku | Wzór związku | Temperatura wrzenia, , | Gęstość cieczy , |
metan | gaz | ||
jodometan | |||
bromometan | gaz | ||
chlorometan | gaz | ||
dichlorometan | |||
trichlorometan | |||
tetrachlorometan | |||
etan | gaz | ||
chloroetan | gaz | ||
bromoetan | |||
jodoetan | |||
propan | gaz | ||
1‑chloropropan | |||
1‑bromopropan | |||
1‑jodopropan | |||
butan | gaz | ||
‑chlorobutan | |||
‑bromobutan | |||
‑jodobutan | |||
pentan | |||
‑chloropentan | |||
‑bromopentan | |||
‑jodopentan | |||
benzen | |||
chlorobenzen | |||
bromobenzen | |||
jodobenzen |
Indeks górny Źródło: Czerwiński A., Czerwińska A., i in., Chemia – podręczniki dla liceum ogólnokształcącego, profilowanego i technikum, Zakres rozszerzony, Warszawa 2019. Indeks górny koniecŹródło: Czerwiński A., Czerwińska A., i in., Chemia – podręczniki dla liceum ogólnokształcącego, profilowanego i technikum, Zakres rozszerzony, Warszawa 2019.
Zapoznaj się z poniższą tabelą, a następnie wykonaj polecenie.
Wzór | 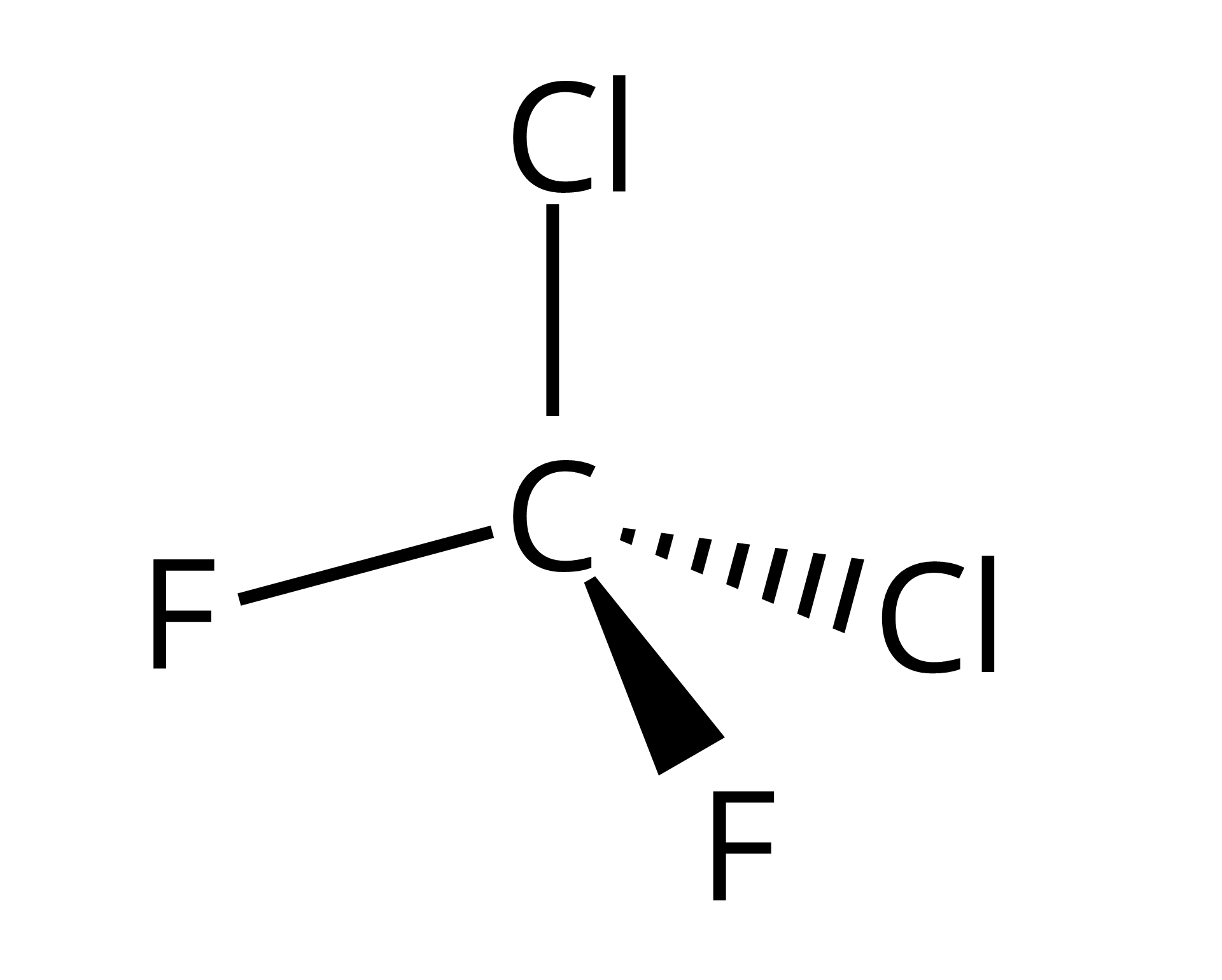 Źródło: GroMar Sp. z o.o., licencja: CC BY-SA 3.0. | 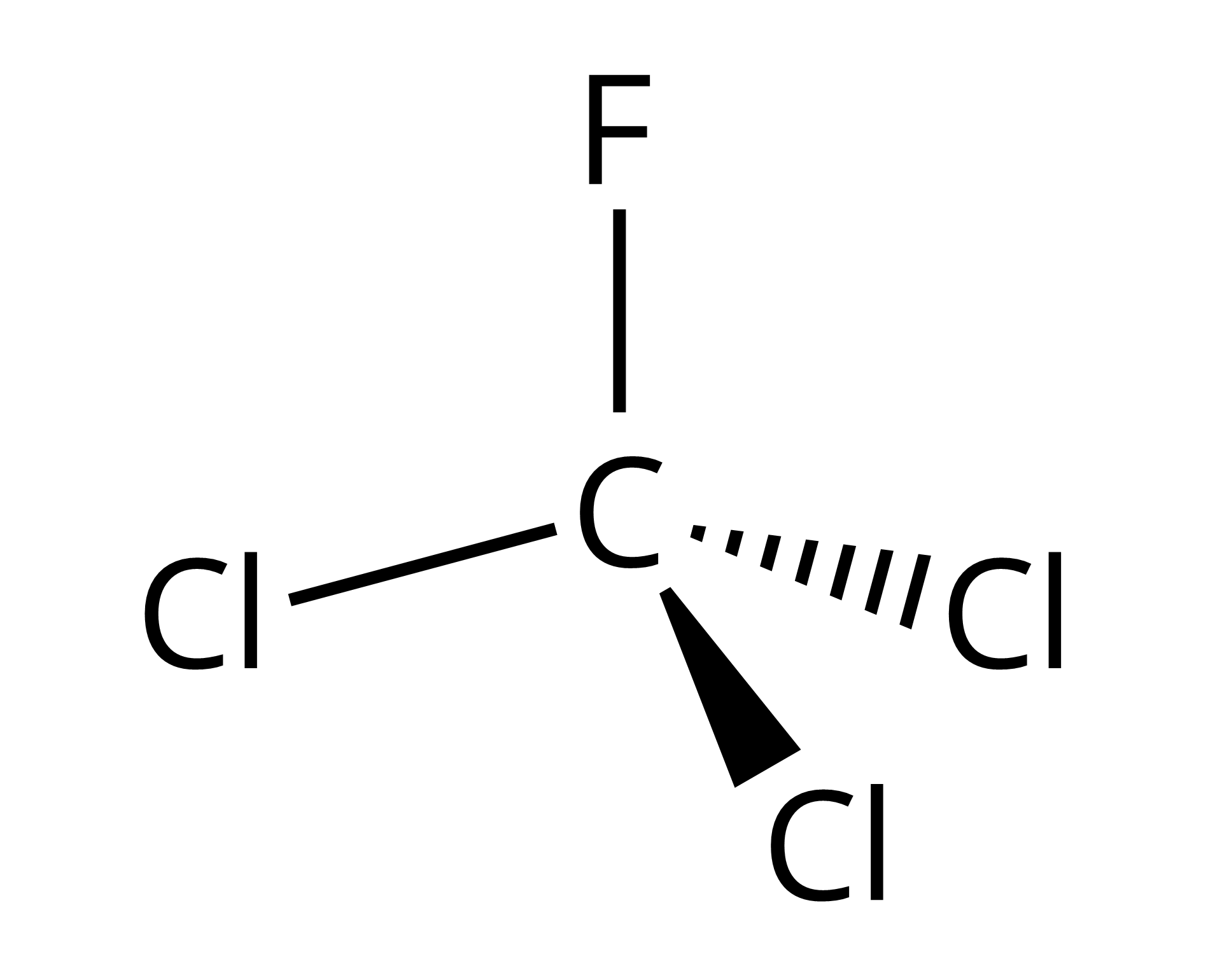 Źródło: GroMar Sp. z o.o., licencja: CC BY-SA 3.0. |
Nazwa systematyczna | dichlorodifluorometan | trichlorofluorometan |
Inne nazwy | freon‑, ‑, ‑12 | freon‑, ‑, ‑ |
Masa molowa | ||
Barwa | bezbarwna | bezbarwna |
Gęstość | ||
Temperatura topnienia | ||
Temperatura wrzenia |
Przygotowano freonu- w temperaturze , który następnie rozpuszczono w odpowiednim rozpuszczalniku organicznym. Oblicz, jakie było stężenie molowe tego roztworu, jeśli wiesz, że otrzymano roztworu o gęstości . Do obliczeń wykorzystaj poniższe dane:
masa molowa freonu-: ;
gęstość freonu-: .