Sprawdź się
Dopasuj odpowiednie równanie kinetyczne do reakcji o wskazanym rzędzie.
<span aria-label="v, równa się, k nawias kwadratowy A zamknięcie nawiasu kwadratowego" role="math"><math><mi>v</mi><mo>=</mo><mi>k</mi><mo>[</mo><mi>A</mi><mo>]</mo></math></span>, <span aria-label="v, równa się, k nawias kwadratowy A zamknięcie nawiasu kwadratowego indeks górny, dwa" role="math"><math><mi>v</mi><mo>=</mo><mi>k</mi><mo>[</mo><mi>A</mi><msup><mo>]</mo><mn>2</mn></msup></math></span>, <span aria-label="v, równa się, k" role="math"><math><mi>v</mi><mo>=</mo><mi>k</mi></math></span>
| 0 rzędu | |
| I rzędu | |
| II rzędu |
Dla podanej poniżej reakcji określ cząsteczkowość, rząd reakcji oraz równanie kinetyczne. Załóż, że reakcja jest jednoetapowa i prosta.
Zdefiniuj pojęcie rzędu reakcji chemicznej.
Na podstawie poniższych równań reakcji i stałych szybkości reakcji, określ rzędowość reakcji.
Wiedząc, że stężenie początkowe tlenku azotu(IV) w reakcji jego rozkładu wynosiło 1,22 , oblicz czas, jaki jest potrzebny do osiągnięcia przez niego stężenia 0,22 . Stała szybkości dla tej reakcji to 0,54 .
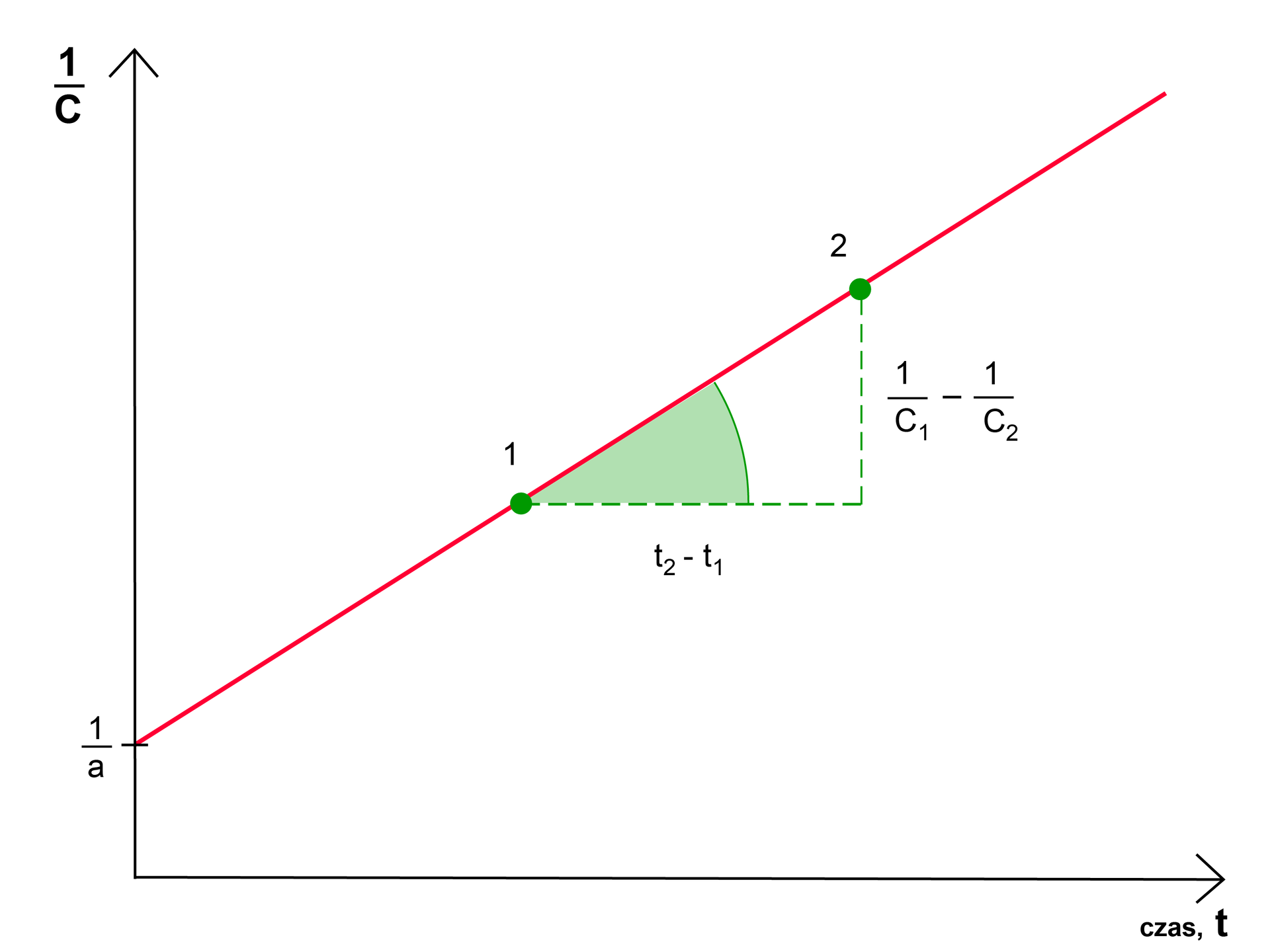
Na podstawie wykresu ustal, jakiego rzędu jest to reakcja.
Pewnej reakcji chemicznej przebiegającej w fazie gazowej, zgodnie z równaniem:
można przypisać równanie kinetyczne postaci:
W czasie pomiarów kinetyki reakcji, w zbiorniku o objętość 2 dmIndeks górny 33 umieszczono 0,9 mola gazu A oraz 1,2 mola gazu B. Zapoczątkowana reakcja chemiczna, w momencie zmieszania reagentów przebiegała z szybkością .
Oblicz wartość stałej szybkości reakcji, opisanej w informacji wprowadzającej, a następnie oblicz szybkość tej reakcji w momencie dokonywania kolejnego pomiaru, kiedy na skutek zachodzącej reakcji z mieszaniny gazów ubyło m.in. 40% substratu A.
Po dokonaniu obliczeń, uzupełnij poniższy tekst tak, aby był prawdziwy.
maleje, I, 1,235 , wzrosła, II, 0,270 , 0,019 , 1,660 , rośnie, zmalała, III
Opisana w informacji wprowadzającej reakcja:
Na podstawie metody izolacyjnej i danych z tabeli, określ rząd reakcji dla podanej reakcji:
Nr reakcji | Stężenie początkowe | Szybkość początkowa | |
|---|---|---|---|
AIndeks dolny 22 | B | ||
1 | 0,45 | 0,27 | 10,8 |
2 | 0,43 | 0,23 | 4,7 |
3 | 0,45 | 0,09 | 3,6 |
Dla pewnej reakcji stała szybkości wynosi 1,5 · 10Indeks górny -4-4 . Oblicz masę substratu pozostałą po upływie dziewięciu godzin, wiedząc, że masa początkowa wynosiła 18 g.