Sprawdź się
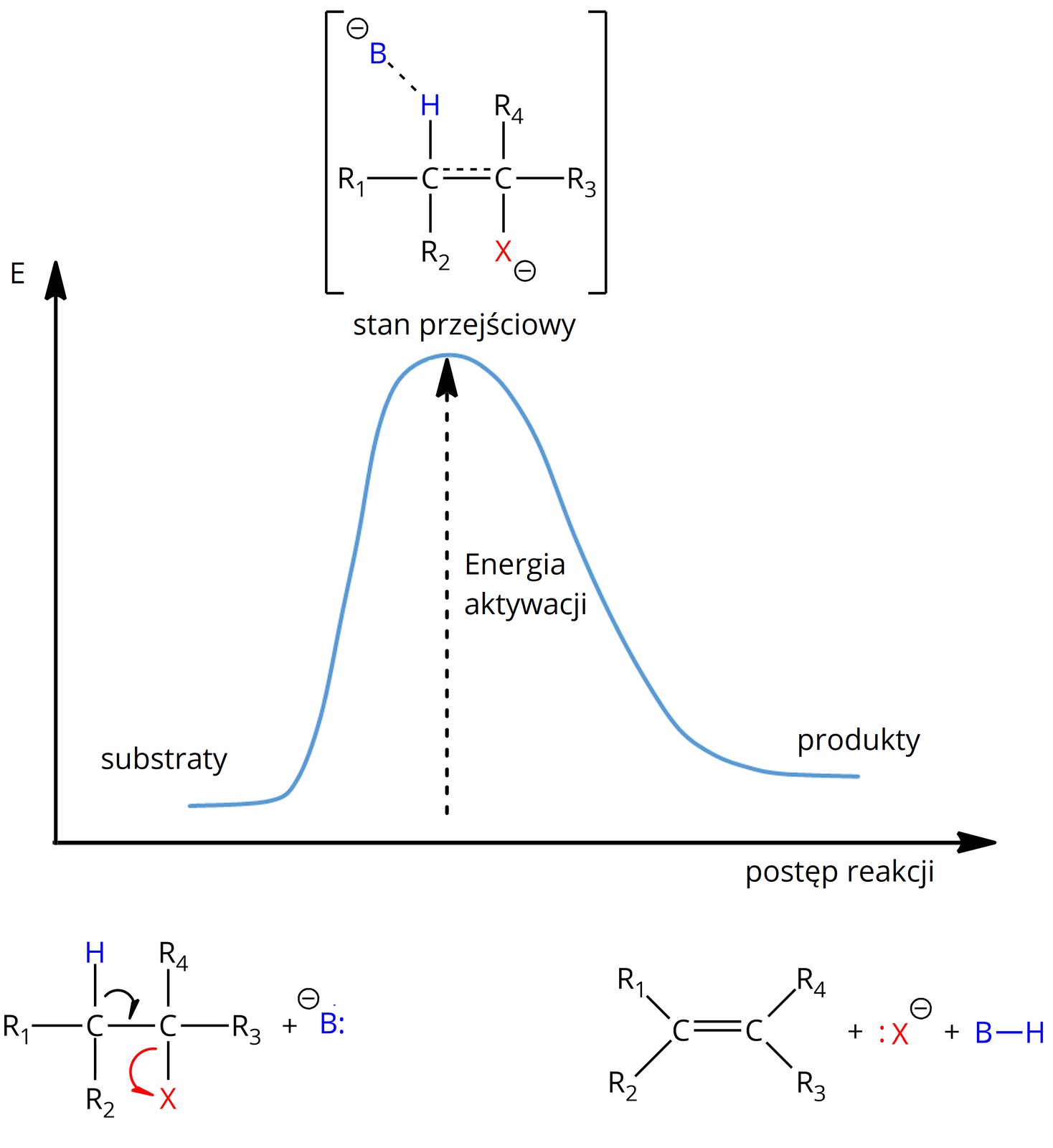
Eliminacja wody z etanolu w środowisku kwasowym zachodzi zgodnie z mechanizmem typu .
Zapisz ogólne równanie kinetyczne dla reakcji eliminacji typu .
Uzupełnij wykres zmian energii w funkcji postępu reakcji dla eliminacji typu .
Zaznacz, czy podane poniżej zdania są prawdziwe, czy fałszywe.
Wyznacz jednostkę stałej szybkości dla reakcji chloroetanu z prowadzącej do powstania etenu, jeżeli wiesz, że reakcja ta zachodzi zgodnie z mechanizmem eliminacji typu , a jednostką szybkości reakcji jest .
W wyniku reakcji, przedstawionej powyższym równaniem, stężenie substratu w mieszaninie reakcyjnej w ciągu minut zmniejszyło się z do . Oblicz średnią szybkość reakcji, jeżeli wiesz, że wartość ta równa jest ilorazowi zmiany stężenia substratu do zmiany czasu wyrażonego w sekundach. Temperatura reakcji była stała.
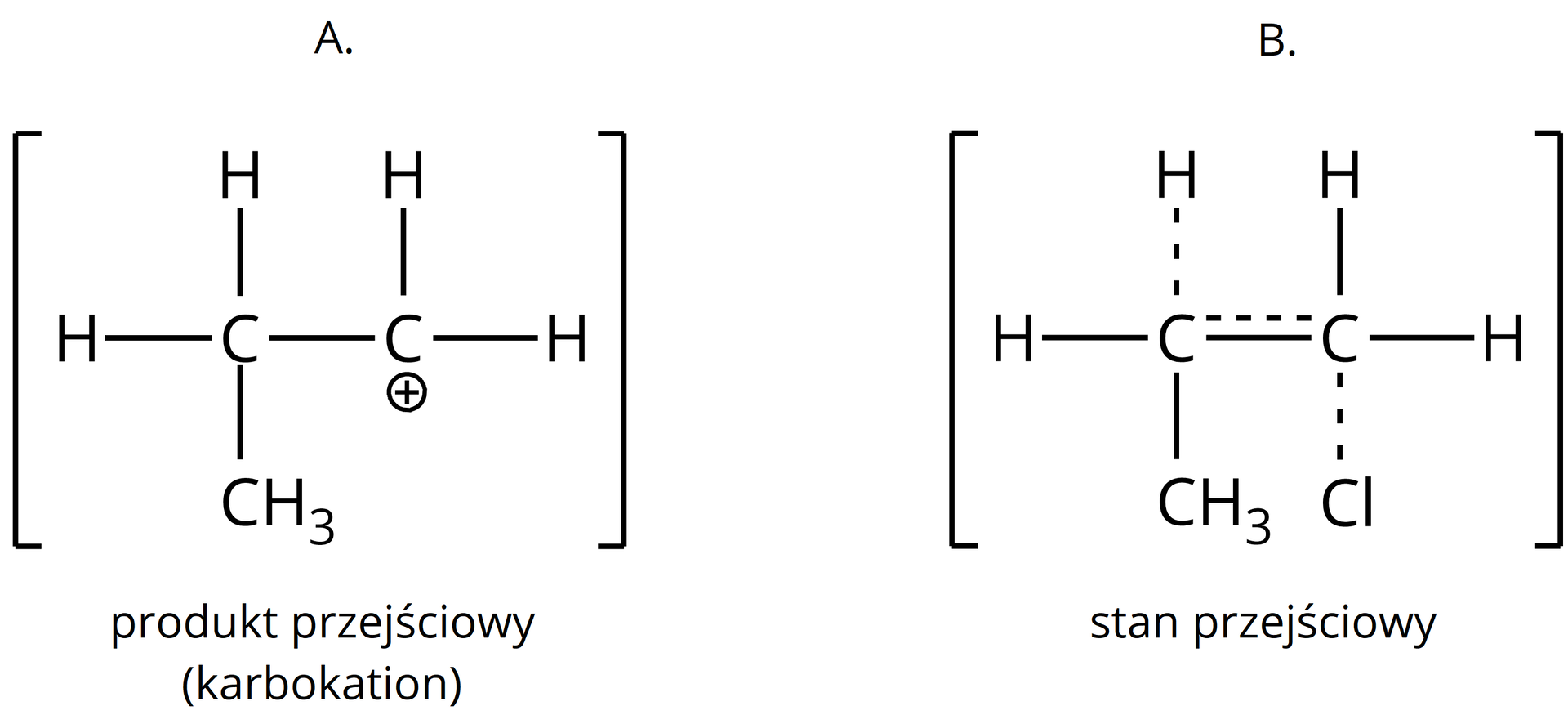
Dla poniższych pochodnych węglowodorów zapisz w zeszycie od chemii formy, jakie powstają w najwolniejszym momencie reakcji.
A.
B.