Sprawdź się
Do zamkniętego reaktora o pojemności 1 wprowadzono 0,50 mola reagenta A oraz 1,80 mola reagenta B. Mieszaninę ogrzano do temperatury T i zainicjowano reakcję chemiczną przebiegającą zgodnie z poniższym równaniem.
Przez 100 sekund oznaczano stężenie substancji A w mieszaninie reakcyjnej, co obrazuje poniższy wykres.
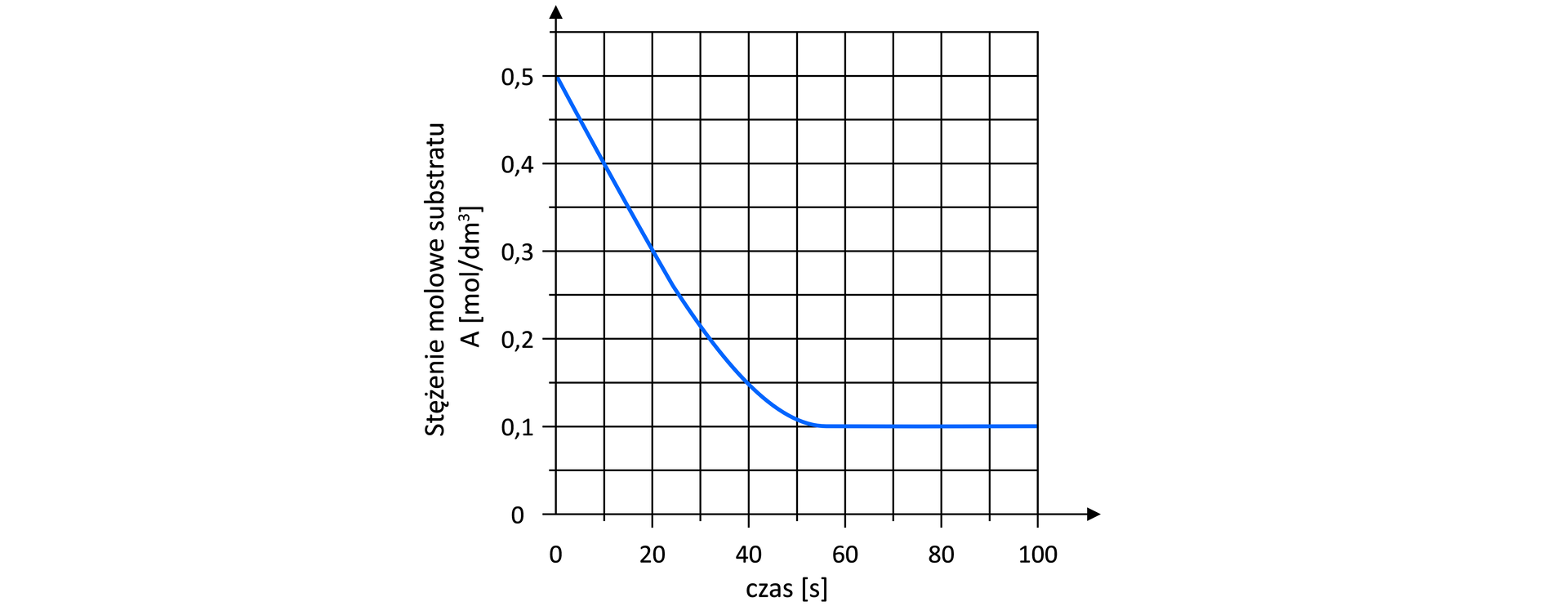
Uzupełnij poniższą tabelę wartościami liczb moli, wyrażającymi zmianę zawartości substratu B w mieszaninie reakcyjnej, w czasie pierwszych 80 sekund trwania reakcji.
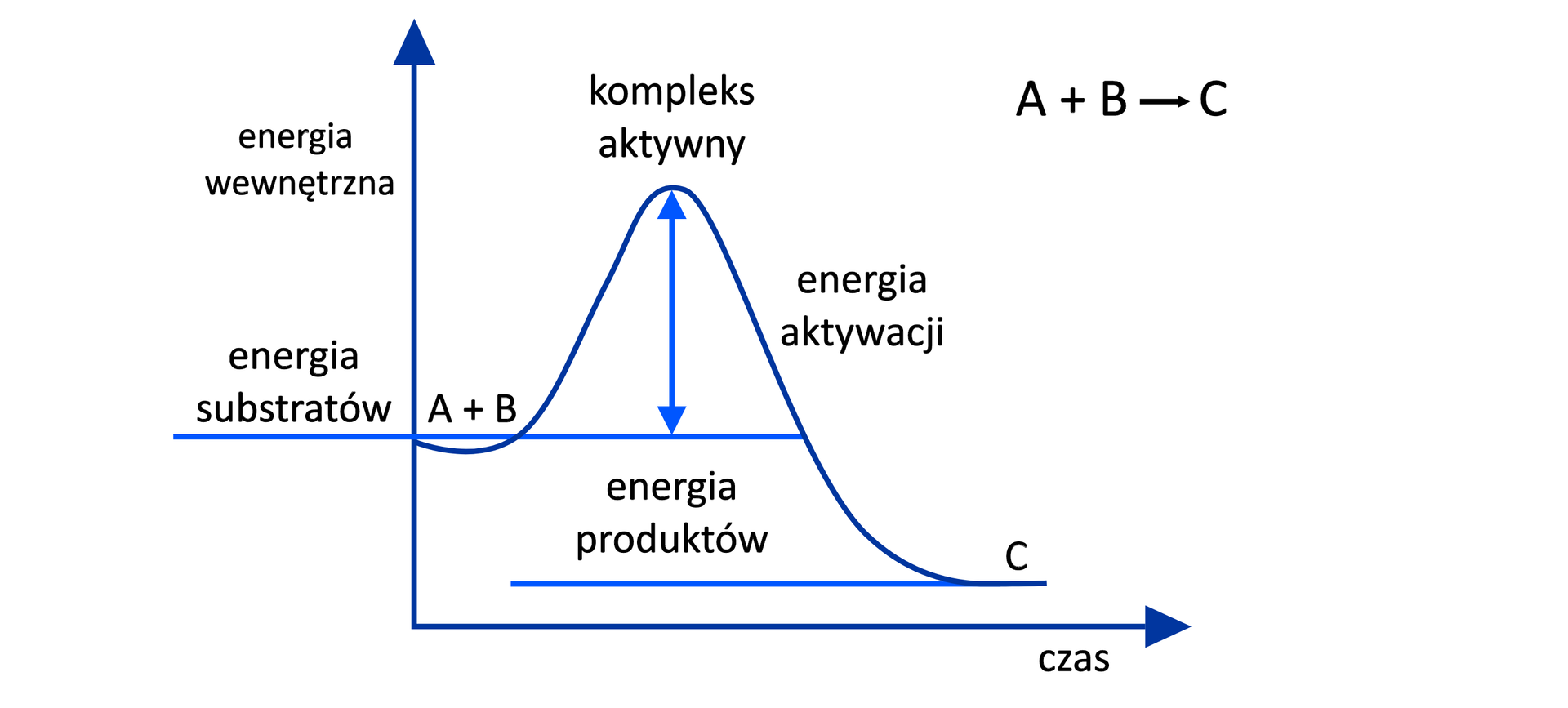
Naszkicuj wykres zależności zmiany energii wewnętrznej od czasu dla podanej egzoenergetycznej reakcji chemicznej. Uwzględnij wszystkie ważne opisy, charakteryzujące ten wykres, i napisz, jak wygląda przykładowy kompleks aktywny dla poniższej reakcji.
Opisz wykres zależności zmiany energii wewnętrznej od czasu dla podanej egzoenergetycznej reakcji chemicznej. Uwzględnij wszystkie ważne opisy, charakteryzujące ten wykres, i napisz, jak wygląda przykładowy kompleks aktywny dla poniższej reakcji.
Nadtlenek wodoru jest związkiem nietrwałym i ulega rozkładowi zgodnie z równaniem:
W temperaturze pokojowej reakcja ta zachodzi powoli, można ją natomiast przyspieszyć dzięki zastosowaniu katalizatora. Na poniższym wykresie zobrazowano wpływ obecności identycznej ilości trzech związków chemicznych na rozkład nadtlenku wodoru.
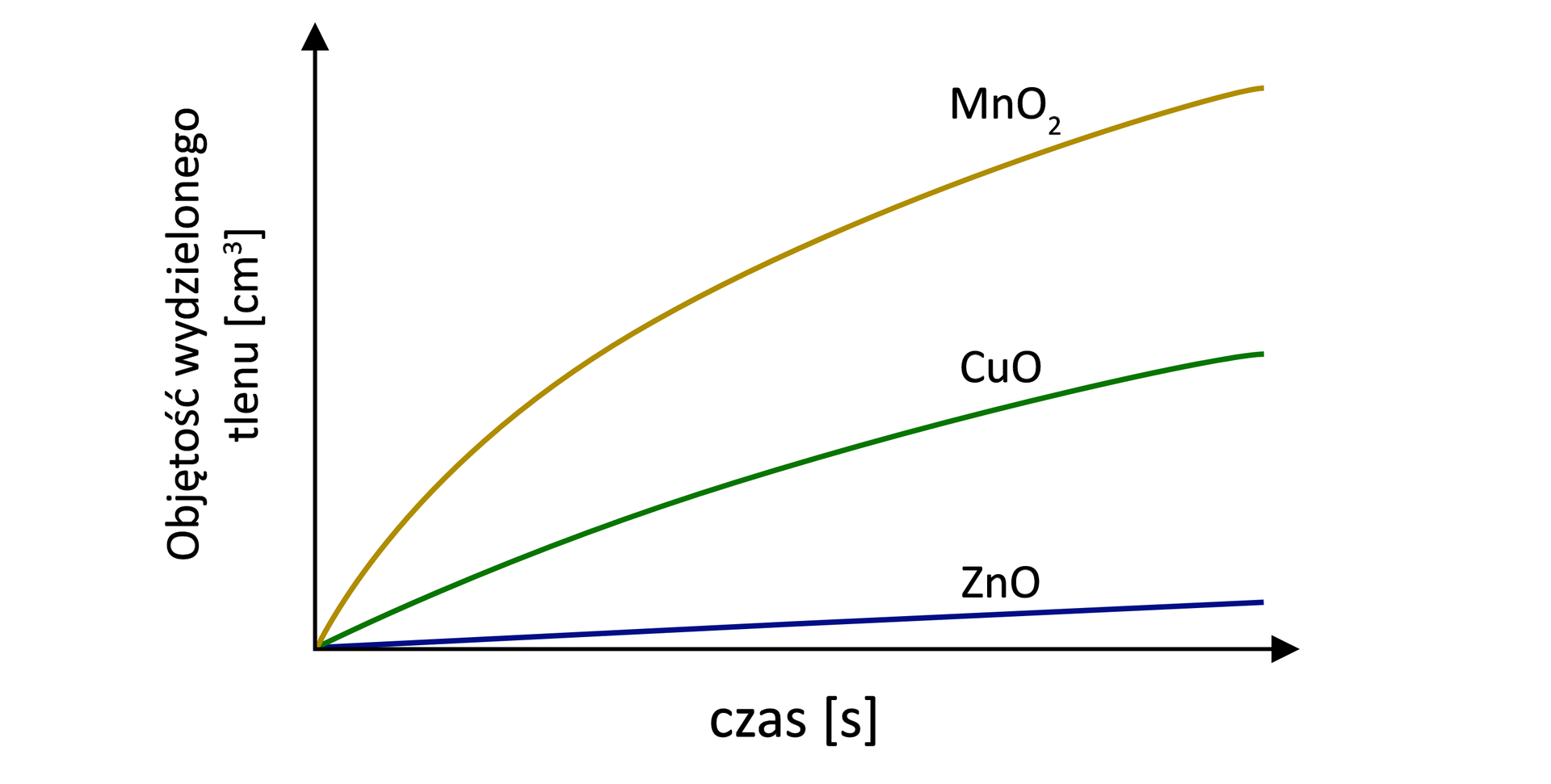
Napisz nazwę systematyczną tego związku, który jest najefektywniejszym katalizatorem reakcji rozkładu nadtlenku wodoru, spośród przedstawionych na wykresie.
Zaznacz postulaty teorii kompleksu aktywnego.
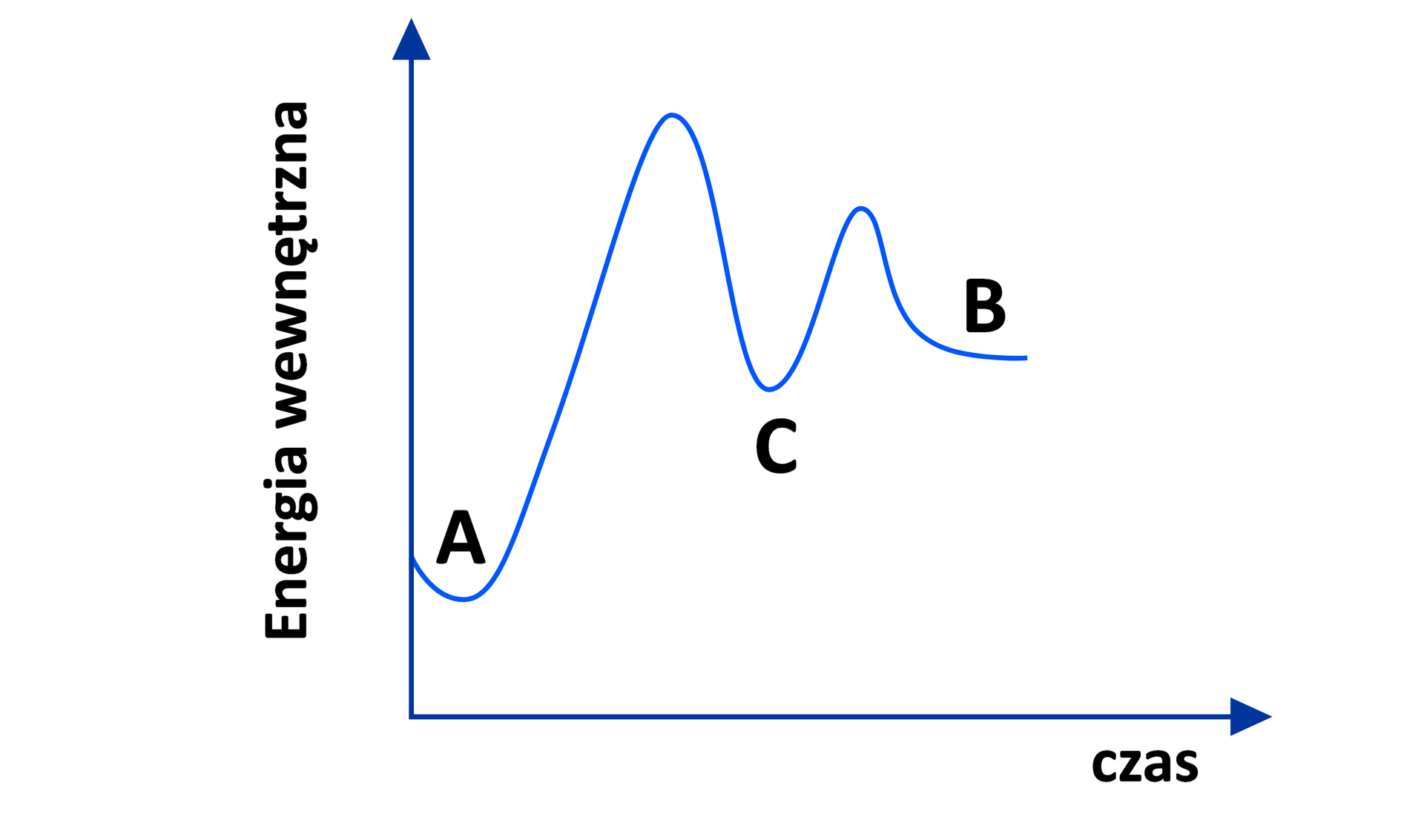
Pewna reakcja przebiega w dwóch etapach przez jeden produkt przejściowy. Na podstawie poniższych informacji narysuj wykres, który właściwie ją opisuje (zależność energii wewnętrznej od czasu).
E1: A → C deltaH > 0
E2: C → B deltaH > 0
Pewna reakcja przebiega w dwóch etapach przez jeden produkt przejściowy. Na podstawie poniższych informacji opisz wykres, który właściwie ją przedstawi (zależność energii wewnętrznej od czasu).
E1: A → C deltaH > 0
E2: C → B deltaH > 0
Uczeń przeprowadził doświadczenie chemiczne, mające na celu sprawdzenie wpływu temperatury, katalizatora oraz rozdrobnienia substratu na przebieg reakcji.
Do trzech różnych probówek dodano takie same ilości rozdrobnionego cynku. Do każdej z nich dodano roztwór kwasu chlorowodorowego o stężeniu 1 .
Do probówki drugiej dodano katalizator w postaci siarczanu(VI) miedzi(II).
Następnie probówkę pierwszą ogrzano w celu sprawdzenia, jak reakcja przebiega w podwyższonej temperaturze.
Dla wszystkich probówek zbierano wydzielający się gaz i zapisano obserwacje.
Oceń poprawność przeprowadzonego doświadczenia.
Napisz, jak poprawnie powinny wyglądać poszczególne próby w przypadku stwierdzenia przez Ciebie niepoprawności ich przeprowadzenia.
Zapisz w szkicowniku równanie reakcji chemicznej, która przebiegała w probówce drugiej.
Rozkład nadtlenku wodoru, w obecności katalizatora, przebiega zgodnie z równaniem kinetycznym:
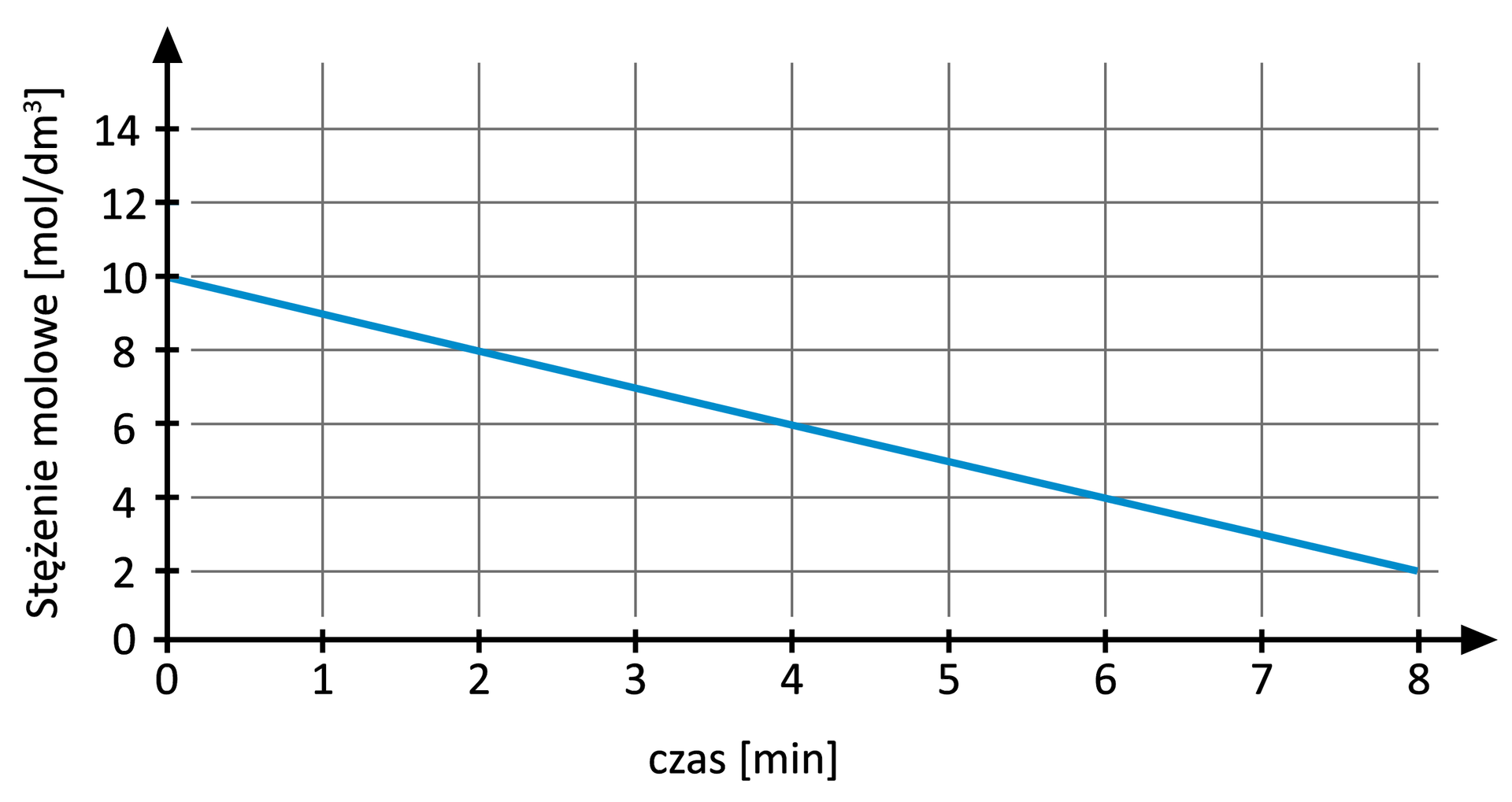
Katalizator dodano do kolby zawierającej roztwór , o stężeniu 10. Po upływie 2 minut zaobserwowano spadek stężenia do 8 , po upływie 4 minut stężenie wynosiło 6 , a po upływie 8 minut zaledwie 2 .
A. Korzystając z powyższego opisu, uzupełnij tabelę i narysuj wykres zależności stężenia nadtlenku wodoru od czasu.
B. Wiedząc, że k = 0,063 , oblicz, po jakim czasie szybkość reakcji będzie równa ʋ = 0,315 .
A. Korzystając z powyższego opisu, uzupełnij oraz podaj, jaką postać będzie miał wykres zależności stężenia nadtlenku wodoru od czasu.
B. Wiedząc, że k = 0,063 , oblicz, po jakim czasie szybkość reakcji będzie równa ʋ = 0,315 .
Na podstawie poniższych schematów zaproponuj doświadczenie pokazujące różnicę między procesem endotermicznym a egzotermicznym i odpowiedz na poniższe pytania.
W zlewce numer jeden i dwa znajduje się po 50 centymetrów sześciennych wody. Do zlewki numer jeden dodano 10 centymetrów sześciennych kwasu siarkowego. Do zlewki numer dwa – 15 gramów azotanu amonu. Zaproponuj doświadczenie pokazujące różnicę między procesem endotermicznym a egzotermicznym i odpowiedz na poniższe pytania.
Dlaczego w trakcie dwóch procesów następuje zmiana temperatury?
W której zlewce nastąpił wzrost, a w której spadek temperatury?
Na podstawie doświadczenia opisz, na czym polega proces egzoenergetyczny, a na czym endoenergetyczny.