Sprawdź się
Wybierz poprawne dokończenia poniższego zdania.
Wysoką wydajność otrzymywania produktów można otrzymać poprzez:
- dodanie substratu.
- usunięcie części produktu z układu reakcyjnego.
- dodanie katalizatora reakcji.
- utrzymywanie stałej temperatury reakcji bez względu na fakt, czy w reakcji wydziela się ciepło, czy nie.
Korzystając z reguły przekory, wskaż, który z czynników może wpłynąć na przesunięcie równowagi reakcji w prawo.
Równanie reakcji:
- dodanie produktu D
- usunięcie substratu B
- dodanie produktu C
- dodanie substratu A
Reakcja syntezy amoniaku przebiega zgodnie z równaniem:
Połącz fragmenty zdania w pary.
zmaleje., wzrośnie.
| Jeśli stężenie H2 zmaleje, to wydajność procesu | |
| Równowaga reakcji przesunie się w lewo, gdy stężenie amoniaku |
W tabeli podano zestaw równań reakcji chemicznych i opis działań. Oceń prawdziwość zdań.
| Reakcja | Działanie | Prawda | Fałsz |
| Wprowadzenie do układu substancji silnie higroskopijnej spowoduje przesunięcie równowagi reakcji w stronę tworzenia CO2. | □ | □ | |
| Usunięcie HCl z układu reakcyjnego nie poprawi wydajności reakcji. | □ | □ | |
| Kiedy zwiększamy stężenie NO2, wówczas układ będzie próbował przetworzyć nadmiar ponownie w substraty. | □ | □ | |
| Wydajność procesu spadnie, gdy dostęp tlenu zostanie ograniczony. | □ | □ |
Zapoznaj się z równaniem reakcji otrzymywania jodowodoru (HI), a następnie uzupełnij tekst.
w lewo, wzrosła, zmniejszyła się, wzrosło, w prawo, stanie równowagi, stanie wzbudzonym, zmniejszyło się
W układzie, znajdującym się w .................................., stężenie jodu ................................... Układ dążył do odtworzenia poprzedniej ilości tego reagenta. Tym samym nastąpił rozpad HI na substraty, a położenie równowagi reakcji przesunęło się ................................... Jednocześnie wydajność procesu tworzenia produktów ...................................
Wstaw odpowiednie słowa w puste pola. W tabeli zaznaczono strzałkami kierunek zmian równowagi reakcji pod wpływem określonych parametrów. Określ, jak zmienić reagent (dodać, usunąć), aby zaprezentowana reakcja chemiczna biegła zgodnie z kierunkiem wskazanym przez strzałki.
Przesunięcie położenia równowagi (kierunek), Sposób zmiany, →, ←, ←, →
| Reagent | Zn | HCl | ZnCl2 | H2 |
|---|---|---|---|---|
| Przesunięcie położenia równowagi (kierunek) | → | ← | ← | → |
| Sposób zmiany |
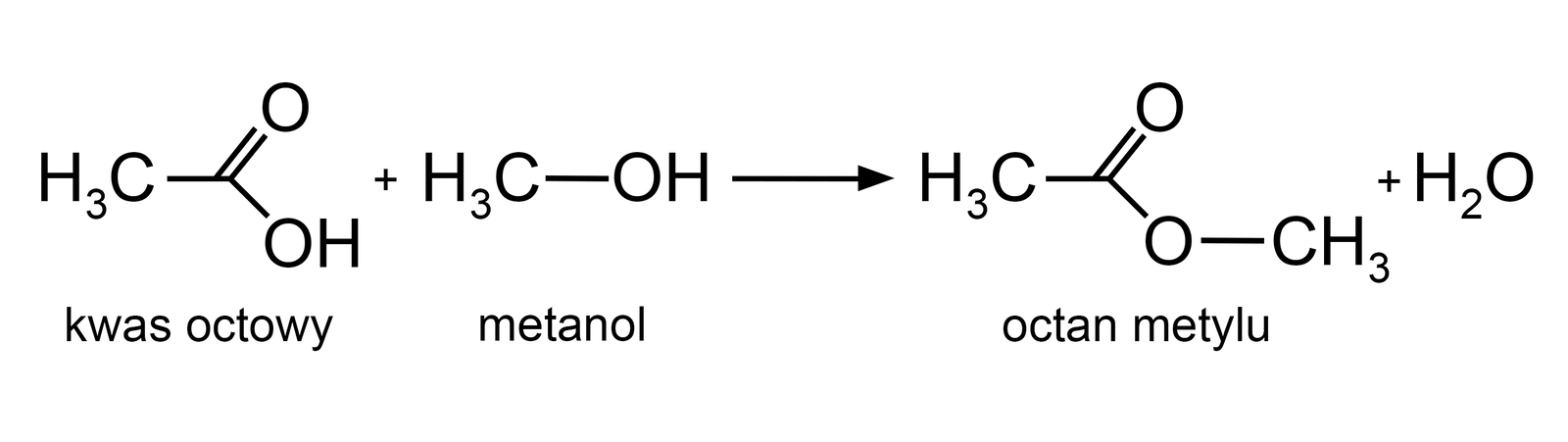
Estryfikacja kwasu karboksylowego z alkoholem, w obecności kwasu (np. kwasu siarkowego(VI)), nazywana jest estryfikacją Fischera. W trakcie trwania procesu wykonywana jest destylacja (rozdział ciekłej mieszaniny wieloskładnikowej), przebiegająca na skutek odparowania i skraplania składników. W jej wyniku, z układu reakcyjnego usuwany jest ester lub woda, albo oba naraz.
Przykład reakcji estryfikacji prezentuje poniższe równanie reakcji.
Zapoznaj się z opisem reakcji estryfikacji.
Jeżeli w zamkniętym reaktorze o stałej objętości zostanie przeprowadzona reakcja chemiczna, w której bierze udział po jednym molu substratów A oraz B, to po pewnym czasie ustali się stan równowagi chemicznej.
Wówczas liczbę moli reagentów na różnych etapach reakcji można obliczyć, korzystając z zależności zamieszczonych w tabeli poniżej.
Reagent | liczba moli początkowych nIndeks dolny 00 [mol] | liczba moli zużytych w reakcji x [mol] | liczba moli w stanie równowagi nIndeks dolny RR [mol] |
|---|---|---|---|
A | 1 | x | 1‑x |
B | 1 | x | 1‑x |
C | 0 | x | x |
D | 0 | x | x |
Reakcja tlenku węgla(IV) z wodorem w fazie gazowej przebiega zgodnie z równaniem:
W zamkniętym reaktorze, o objętości 1 dmIndeks górny 33, zmieszano ze sobą 3 mole i 4 mole . Stan równowagi ustalił się, gdy powstały 2 mole każdego z produktów. Temperatura w układzie była stała.
Oblicz stężenia wodoru i tlenku węgla(IV) po ustaleniu się stanu równowagi.