Sprawdź się
1. , 2. , 3. , 4. , 5. , 6. , 7. , 8. , 9. , 10. , 11. , 12. , 13. , 14. , 15. , 16. , 17. 1. , 2. , 3. , 4. , 5. , 6. , 7. , 8. , 9. , 10. , 11. , 12. , 13. , 14. , 15. , 16. , 17. 1. , 2. , 3. , 4. , 5. , 6. , 7. , 8. , 9. , 10. , 11. , 12. , 13. , 14. , 15. , 16. , 17. 1. , 2. , 3. , 4. , 5. , 6. , 7. , 8. , 9. , 10. , 11. , 12. , 13. , 14. , 15. , 16. , 17. 1. , 2. , 3. , 4. , 5. , 6. , 7. , 8. , 9. , 10. , 11. , 12. , 13. , 14. , 15. , 16. , 17.
Uzupełnij równania reakcji tlenku manganu(IV) z kwasem chlorowodorowym oraz kwasem siarkowym(VI). Przeciągnij odpowiednie wyrażenia w puste pola.
, , , , , , , , , , , , , , , ,
................................................
........................ ....................................
- Konfiguracja elektronowa 1. , 2. , 3. , 4. , 5. , 6. , 7. , 8. , 9. , 10. , 11. , 12. , 13. , 14. , 15. , 16. , 17. 1. , 2. , 3. , 4. , 5. , 6. , 7. , 8. , 9. , 10. , 11. , 12. , 13. , 14. , 15. , 16. , 17. 1. , 2. , 3. , 4. , 5. , 6. , 7. , 8. , 9. , 10. , 11. , 12. , 13. , 14. , 15. , 16. , 17. 1. , 2. , 3. , 4. , 5. , 6. , 7. , 8. , 9. , 10. , 11. , 12. , 13. , 14. , 15. , 16. , 17. 1. , 2. , 3. , 4. , 5. , 6. , 7. , 8. , 9. , 10. , 11. , 12. , 13. , 14. , 15. , 16. , 17. 1. , 2. , 3. , 4. , 5. , 6. , 7. , 8. , 9. , 10. , 11. , 12. , 13. , 14. , 15. , 16. , 17. 1. , 2. , 3. , 4. , 5. , 6. , 7. , 8. , 9. , 10. , 11. , 12. , 13. , 14. , 15. , 16. , 17.
- Liczba elektronów niesparowanych w atomie manganu: 1. , 2. , 3. , 4. , 5. , 6. , 7. , 8. , 9. , 10. , 11. , 12. , 13. , 14. , 15. , 16. , 17.
- Konfiguracja elektronowa: 1. , 2. , 3. , 4. , 5. , 6. , 7. , 8. , 9. , 10. , 11. , 12. , 13. , 14. , 15. , 16. , 17. 1. , 2. , 3. , 4. , 5. , 6. , 7. , 8. , 9. , 10. , 11. , 12. , 13. , 14. , 15. , 16. , 17. 1. , 2. , 3. , 4. , 5. , 6. , 7. , 8. , 9. , 10. , 11. , 12. , 13. , 14. , 15. , 16. , 17. 1. , 2. , 3. , 4. , 5. , 6. , 7. , 8. , 9. , 10. , 11. , 12. , 13. , 14. , 15. , 16. , 17. 1. , 2. , 3. , 4. , 5. , 6. , 7. , 8. , 9. , 10. , 11. , 12. , 13. , 14. , 15. , 16. , 17. 1. , 2. , 3. , 4. , 5. , 6. , 7. , 8. , 9. , 10. , 11. , 12. , 13. , 14. , 15. , 16. , 17.
, , , , , , , , , , , , ,
Liczba elektronów niesparowanych: ............
Do probówki, zawierającej bladoróżowy roztwór siarczanu() manganu(), dodano wodorotlenku sodu. Wytrącił się wtedy biały osad. Następnie dodano wodę utlenioną. Osad zmienił barwę na ciemnobrunatną.
Odpowiedz, która z dwóch opisanych wyżej reakcji zachodzi bez zmian stopni utlenienia?
Zapisz równania reakcji. W przypadku reakcji utleniania–redukcji, współczynniki stechiometryczne w równaniu dobierz metodą bilansu elektronowego.
Zapisz w formie cząsteczkowej równania reakcji zachodzących na schemacie.

Wstaw odpowiednie wyrażenia w luki w tekście.
wodorek manganu(II), chlorek manganu(II), chlorek manganu(VII), wodorotlenek manganu(VII), rozpuszczalny, wodorotlenek manganu(IV), wodorotlenek manganu(II), nierozpuszczalny
W wyniku reakcji kwasu chlorowodorowego z metalicznym manganem powstaje .................................................., w reakcji z wodorotlenkiem, na przykład wodorotlenkiem sodu, otrzymuje się .................................................., który jest .................................................. w wodzie.
Mangan tworzy kilka tlenków, w których występuje na , i stopniu utlenienia.
A. Jak zmienia się charakter kwasowo‑zasadowy tlenków manganu? Uzupełnij tabelę, przeciągając odpowiednie wyrażenia w puste pola.
Charakter chemiczny, zasadowy, zasadowy, zasadowy, amfoteryczny, kwasowy, obojętny, kwasowy, amfoteryczny, kwasowy, obojętny
| Tlenek | ||||
|---|---|---|---|---|
| Charakter chemiczny |
W pracowni chemicznej znajduje się manganianu() potasu. Ile tlenu (w warunkach normalnych) można otrzymać z takiej ilości soli poprzez jej ogrzewanie? Zakładamy wydajność reakcji termicznego rozkładu.
Za pomocą równań reakcji chemicznych w formie cząsteczkowej zapisz przemiany przedstawione na poniższym schemacie, zaznaczając warunki konieczne do ich przebiegu.
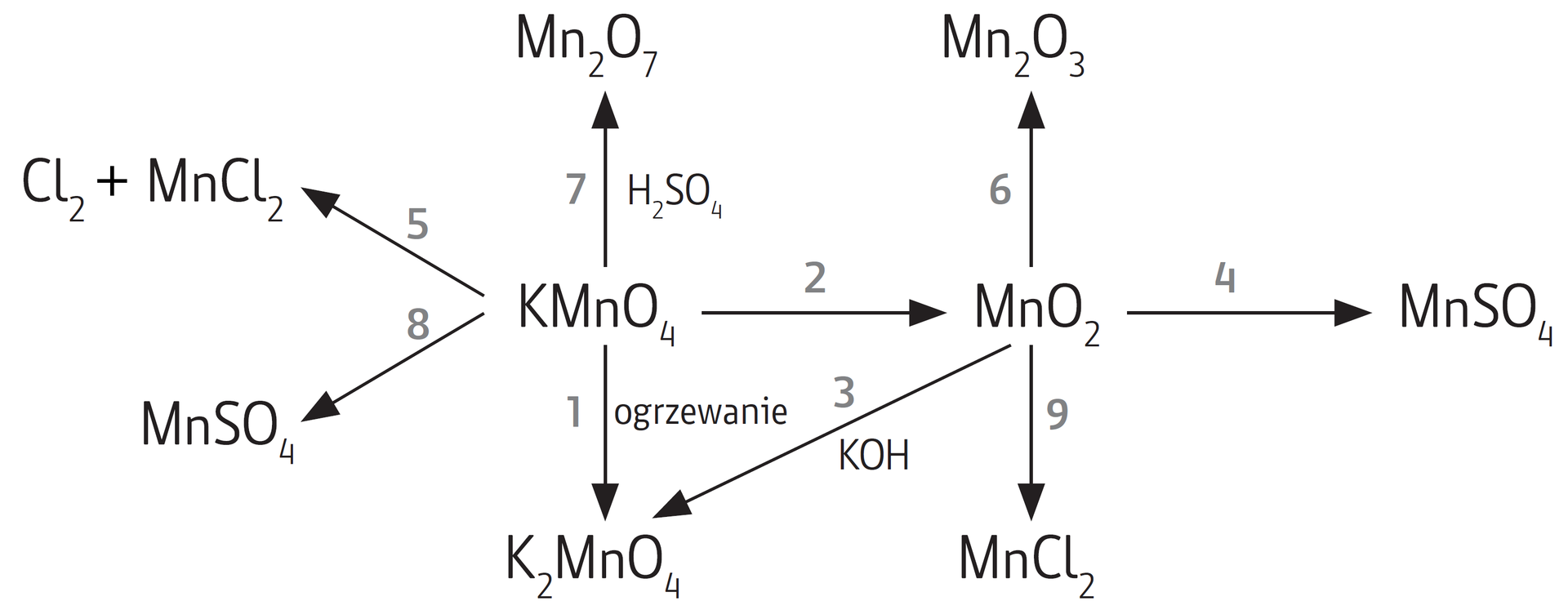
Wstaw odpowiednie wyrażenia w luki w tekście.
tlenek manganu(VI), manganianu(VI) potasu, redukcji, utlenienia, tlenek manganu(VII), manganianu(IV) potasu, tlenek manganu(IV)
Manganian(VII) potasu w wyniku ogrzewania ulega przemianie do .........................................., w reakcji z kwasem siarkowym(VI) tworzy ........................................... W wyniku .......................................... manganianu(VII) potasu w środowisku obojętnym powstaje ...........................................
Ustal, które z przedstawionych poniżej równań reprezentują reakcje utleniania‑redukcji. Metodą bilansu elektronowego dobierz współczynniki stechiometryczne w tych równaniach.