Sprawdź się
Uzupełnij tekst odpowiednimi słowami.
Ułóż w odpowiedniej kolejności czynności związane z wydobyciem soli kamiennej metodą mokrą.
Skład soli drogowej wg normy PN‑86/C‑84081/02:
zawartość chlorku sodu – co najmniej masowych;
zawartość substancji nierozpuszczalnych w wodzie – maksymalnie ;
zawartość wody – maksymalnie ;
zawartość żelazocyjanku potasu (dodawanego w celu zapobiegania zbrylaniu soli) – .
Pobrano próbkę soli o masie , którą wyprażono w . Po wyprażeniu, masa próbki zmniejszyła się o .
Wiedząc, że w próbce znajdowały się tylko woda oraz sole nieorganiczne o temperaturze topnienia wyższej niż , zastanów się, czy ta sól może być wykorzystana do produkcji soli drogowej.
Poniżej opisano skład soli drogowej wg Normy PN‑86/C‑84081/02:
zawartość chlorku sodu – co najmniej masowych;
zawartość substancji nierozpuszczalnych w wodzie – maksymalnie ;
zawartość wody – maksymalnie ;
zawartość żelazocyjanku potasu (dodawanego w celu zapobiegania zbrylaniu soli) – .
Oblicz, jaką minimalną masę wody należałoby odparować z surowej soli o zawartości masowych wody, aby mogła być użyta jako sól drogowa. Wynik podaj w kilogramach, w zaokrągleniu do jedności. W obliczeniach załóż, że w skład soli surowej i soli drogowej wchodzą wyłącznie chlorek sodu i woda.
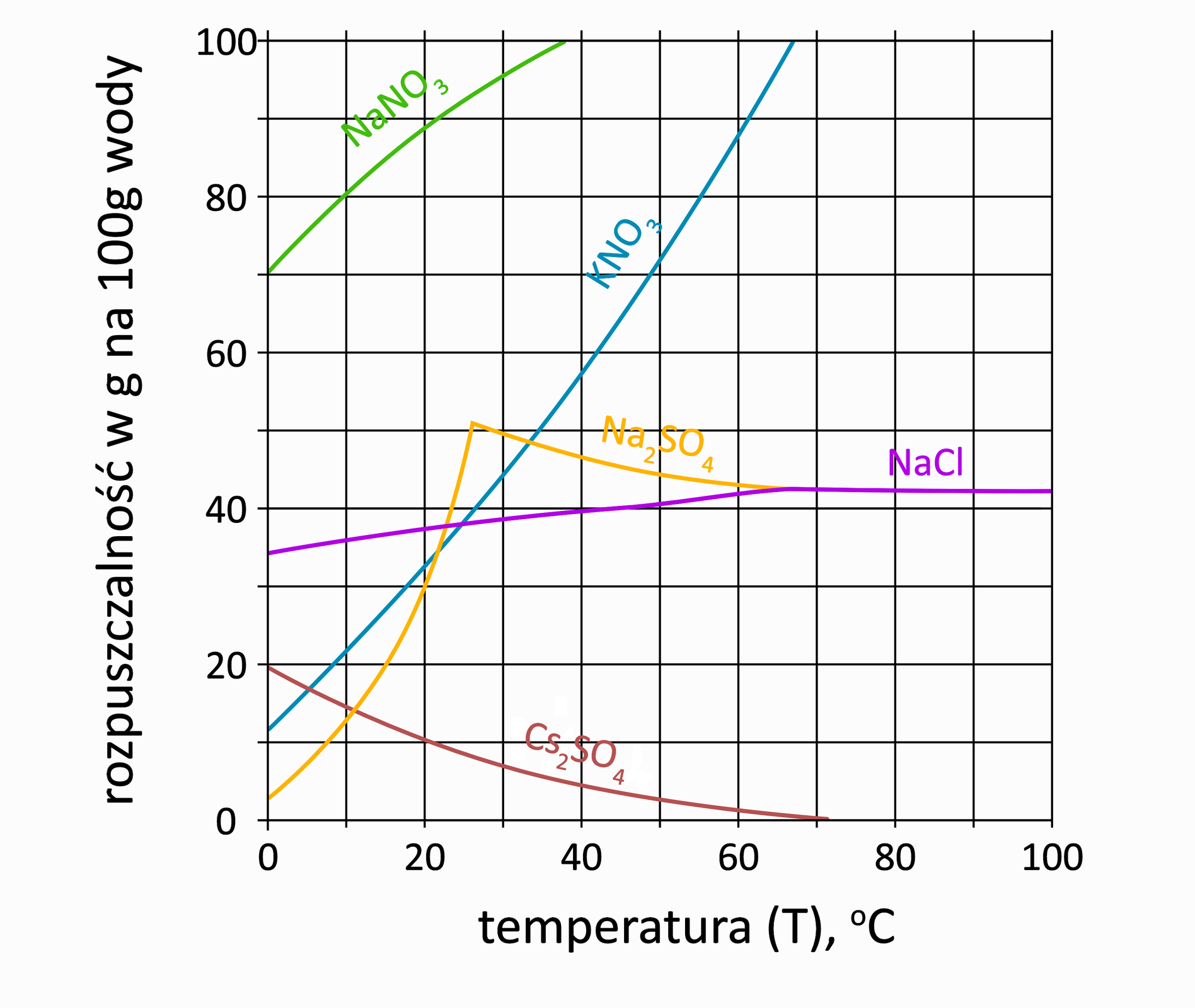
Na podstawie poniższego wykresu wykonaj poniższe polecenia.
Rozpuszczalność chlorku sodu w temperaturze 40°C wynosi: Możliwe odpowiedzi: 1. ok. 75 gramów., 2. ok. 25 gramów., 3. ok. 40 gramów., 4. ok. 60 gramów.
Oblicz stężenie procentowe nasyconego wodnego roztworu chlorku sodu w temperaturze . Wynik podaj z dokładnością do pierwszego miejsca po przecinku.
Poniżej zamieszczono krzywe rozpuszczalności wybranych soli.

Korzystając z powyższego wykresu:
A. Oblicz, ile kilogramów wody górskiej o temperaturze jest potrzebne, aby rozpuścić chlorku sodu w jednym z etapów metody mokrej. Wynik podaj w zaokrągleniu do liczb całkowitych. W obliczeniach przyjmij, że woda górska jest czystym rozpuszczalnikiem.
B. Oblicz stężenie procentowe solanki otrzymanej po rozpuszczeniu chlorku sodu w obliczonej w punkcie A masie wody górskiej. Wynik podaj w zaokrągleniu do liczb całkowitych.
Oblicz, ile kilogramów wody górskiej o temperaturze jest potrzebne, aby rozpuścić chlorku sodu w jednym z etapów metody mokrej, wiedząc, że rozpuszczalność chlorku sodu w tej temperaturze wynosi ok. . Wynik podaj w zaokrągleniu do liczb całkowitych. W obliczeniach przyjmij, że woda górska jest czystym rozpuszczalnikiem.
Następnie oblicz stężenie procentowe solanki otrzymanej po rozpuszczeniu chlorku sodu w obliczonej masie wody górskiej. Wynik podaj w zaokrągleniu do liczb całkowitych.
Uczeń przygotował nasyconego wodnego roztworu soli kamiennej, o temperaturze . Następnie roztwór stopniowo ochładzał aż do osiągnięcia temperatury . Korzystając z zamieszczonego poniżej wykresu, oblicz, ile gramów chlorku sodu wykrystalizuje z roztworu po opisanym jego ochłodzeniu. Wynik podaj z dokładnością do pierwszego miejsca po przecinku. W obliczeniach przyjmij, że sól kamienna to czysty chlorek sodu.

Uczeń przygotował nasyconego wodnego roztworu soli kamiennej o temperaturze . Następnie roztwór stopniowo ochładzał, aż do osiągnięcia temperatury . Oblicz, ile gramów chlorku sodu wykrystalizuje z roztworu po opisanym jego ochłodzeniu, wiedząc, że:
rozpuszczalność w temp. () wynosi ok. ;
rozpuszczalność w temp. () wynosi ok. .
Wynik podaj z dokładnością do pierwszego miejsca po przecinku. W obliczeniach przyjmij, że sól kamienna to czysty chlorek sodu.