Sprawdź się
Zaznacz, które z podanych cząsteczek mogą być ligandami.
- anion cyjankowy
- amoniak
- metan
- woda
- kation sodu
Wskaż, które reakcje są reakcjami kompleksowania (reakcje kwas-zasada w teorii Lewisa). Wskaż ligandy.
- Wszystkie odpowiedzi są prawidłowe.
Utwórz nazwy poniższych kompleksów.
Podaj wzory poniższych kompleksów.
chlorek heksaakwamanganu();
pentakarbonylżelazo().
Podaj nazwy związków koordynacyjnych oraz wskaż ich ligandy.
Wskaż ligand w poszczególnych równaniach reakcji kompleksowania.
„Żelazicyjanek potasu” jest nazwą zwyczajową soli potasowej związku kompleksowego, który zawiera jon żelaza(), skoordynowany sześcioma jonami cyjankowymi. Ustal wzór tego związku.
W zależności od stężenia, roztwór chlorku miedzi() w wodzie może przyjmować barwę od niebieskiej do zielonej, w skutek stopniowej wymiany ligandów „akwa” z kompleksu na „chloro–”. Zakładając, że liczba koodynacyjna tych kompleksów się nie zmienia i wynosi cztery, zapisz wzory wszystkich kompleksów miedzi(), jakie mogą występować w tych roztworach.
Osad świeżo wytrąconego ulega roztworzeniu, z powstaniem klarownego szafirowego roztworu, po dodaniu związków, zawierających więcej niż jedną grupę hydroksylową (np. gliceryna, sacharoza). Takich objawów nie obserwuje się na skutek reakcji ze związkami, które posiadają tylko jedną grupę hydroksylową w cząsteczce (np.etanol, metanol). Uzupełnij tekst w oparciu o powyższą informację wprowadzającą.
świadczy, nie świadczy, rolę liganda w tym kompleksie może pełnić dowolny organiczny związek, zawierający grupę , ligandem jest cząsteczka zawierająca co najmniej dwie grupy hydroksylowe
Powyższa obserwacja ...................................................................................................................................................................................................... o tworzeniu się kompleksu chelatowego, ponieważ .......................................................................................................................................................................................................
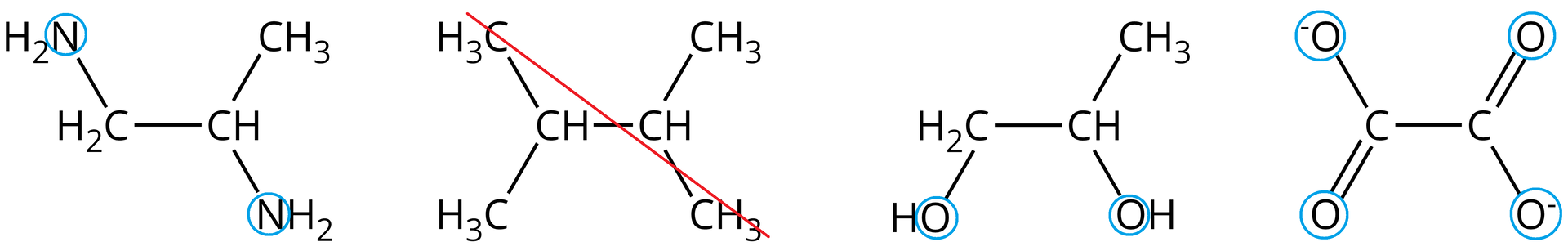
Spośród poniższych wzorów wybierz ligandy chelatowe i zaznacz w nich atomy donorowe. Pozostałe wzory przekreśl.
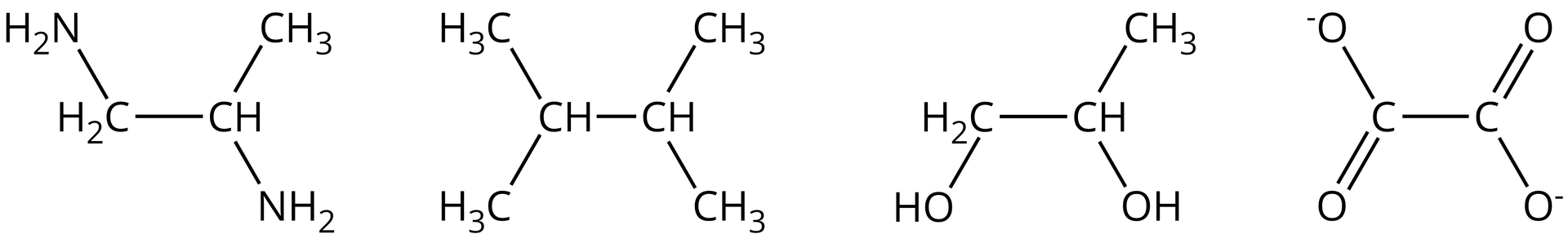
Zaznacz zdania, w których podano prawdziwe informacje o ligandach chelatowych.
- Posiadają co najmniej dwa atomy elektrodonorowe.
- Posiadają co najmniej trzy atomy elektrodonorowe
- Atomami donorowymi są na przykład tlen, azot, siarka
- Atomami donorowymi są na przykład sód, bar.