Sprawdź się
Rozżarzony kawałek siarki, zanurzony w stężonym roztworze kwasu azotowego(V), zapala się. Podaj jakie zasady BHP trzeba zastosować, wykonując to doświadczenie.
Rozżarzony kawałek siarki, zanurzony w stężonym roztworze kwasu azotowego(V), zapala się. Napisz wzory sumaryczne reagentów, które biorą udział w reakcji. Podaj ich nazwy.
Rozżarzony kawałek siarki, zanurzony w stężonym roztworze kwasu azotowego(V), zapala się. Ułóż bilans jonowo‑elektronowy i ustal współczynniki w równaniu reakcji, wskaż utleniacz i reduktor.
Na rysunku ukazano polaryzację cząsteczek halogenowodoru, . Od lewej , , i .
Zapoznaj się z opisem rysunku, na którym ukazano polaryzację cząsteczek halogenowodoru, . Od lewej , , i .
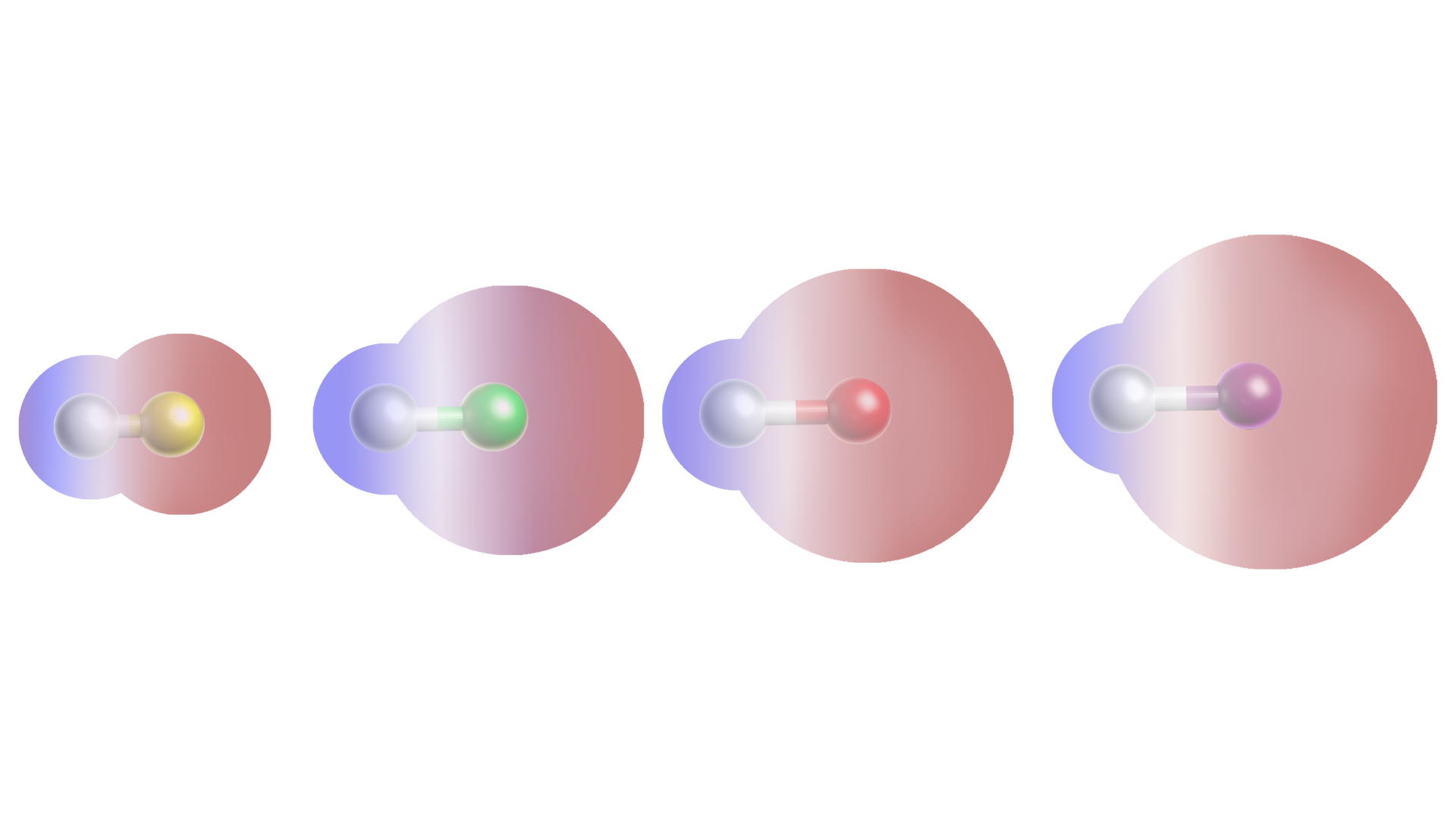
Wyjaśnij, dlaczego na powyższych rysunkach chmurę elektronową zaznaczono różnymi barwami.

Na podstawie powyższego rysunku opisz zmiany budowy cząsteczek i ich wpływ na typ wiązania i polaryzację cząsteczek.
Na podstawie opisu rysunku opisz zmiany budowy cząsteczek i ich wpływ na typ wiązania i polaryzację cząsteczek.
Elektroujemność spada z ............ do ............, a zatem biegunowość maleje z ............ do .............
Cząsteczki wodorków niemetali, których wodne roztwory to kwasy beztlenowe, powstają w wyniku reakcji syntezy cząsteczki niemetalu i cząsteczki wodoru.

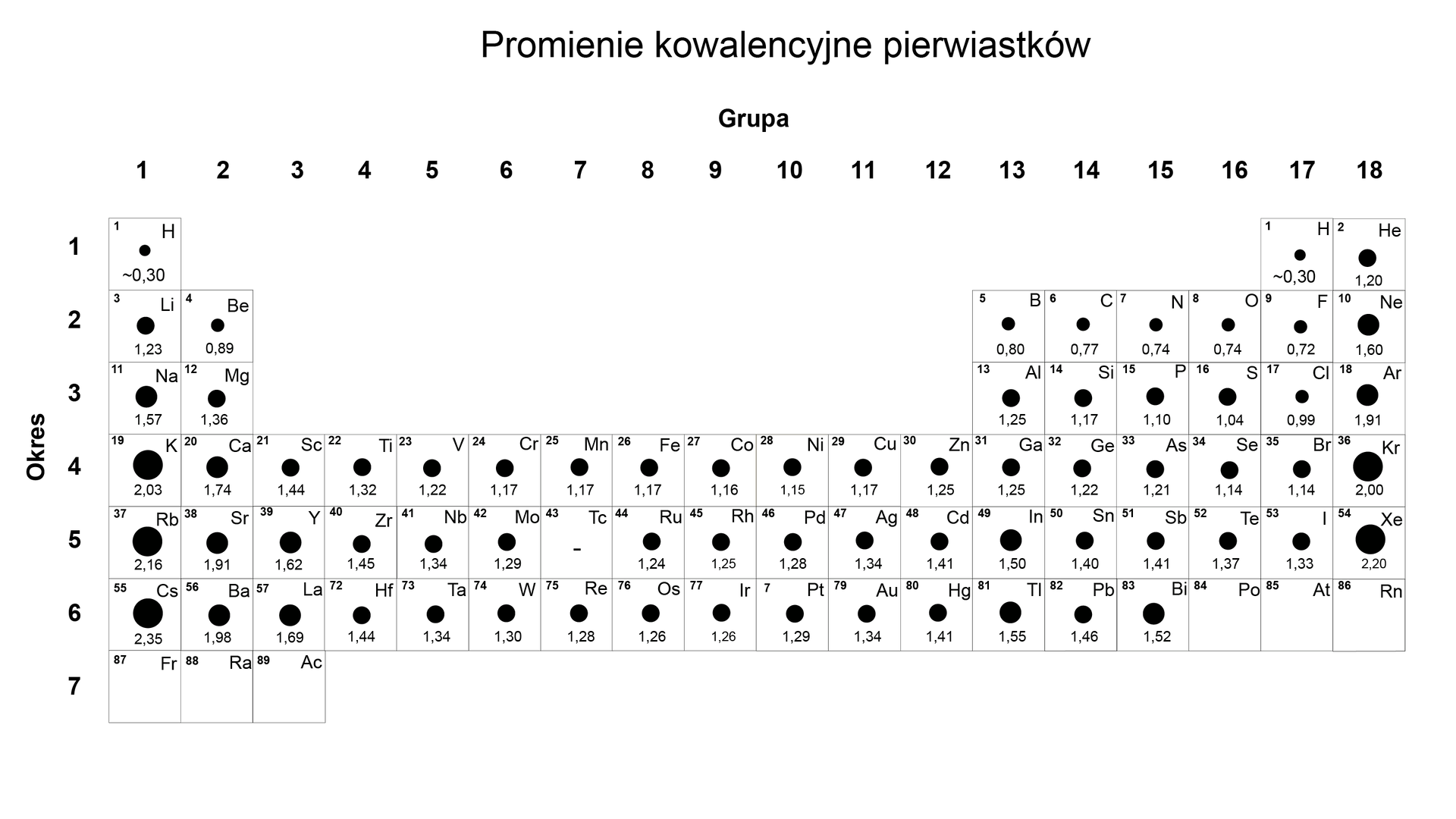
Na podstawie powyższych informacji określ typ wiązania w omawianych wodorkach niemetali.
jonowe, kowalencyjne spolaryzowane, kowalencyjne niespolaryzowane, HI, spolaryzowane, HF, wodorowe, HCl
W kwasach beztlenowych występują wiązania ........................................................... Najmocniej .......................................................... wiązanie występuje w .........................................................., a najsłabiej w ...........................................................
Uszereguj kwasy beztlenowe według ich mocy – od najsłabszego do najmocniejszego.
- HCl
- HI
- HF
- HBr
Na podstawie powyższych informacji wyjaśnij, czemu kwas chlorowodorowy jest mocniejszym kwasem niż kwas jodowodorowy.
Wyjaśnij, czemu kwas fluorowodorowy jest słabszym kwasem niż kwas jodowodorowy, wiedząc że wartość elektroujemności chloru w skali Paulinga wynosi 3,16, a jodu 2,66.