Sprawdź się
Przyporządkuj podane związki zgodnie z oddziaływaniami pomiędzy ich atomami.
Chlorki potasu i wapnia są związkami, w których występuje wiązanie jonowe. Wybierz to spośród podanych stwierdzeń, które jest prawdziwe dla substancji o budowie jonowej.
Poniższa tabela przedstawia zależność udziału wiązania jonowego od różnicy elektroujemności atomów tworzących związek.
Różnica elektroujemności | Udział wiązania jonowego [%] |
|---|---|
0,2 | 1 |
0,4 | 4 |
0,6 | 9 |
0,8 | 15 |
1,0 | 22 |
1,2 | 30 |
1,4 | 39 |
1,6 | 47 |
1,8 | 55 |
2,0 | 63 |
2,2 | 70 |
2,4 | 76 |
2,6 | 82 |
2,8 | 86 |
3,0 | 89 |
3,2 | 92 |
Indeks górny Źródło: Litwin M., Styka‑Wlazła Sz., Szymońska J., Chemia ogólna i nieorganiczna, Podręcznik dla liceum, cz. 1, Warszawa 2004, s. 59. Indeks górny koniecŹródło: Litwin M., Styka‑Wlazła Sz., Szymońska J., Chemia ogólna i nieorganiczna, Podręcznik dla liceum, cz. 1, Warszawa 2004, s. 59.
Chlorek magnezu można otrzymać wieloma sposobami. Metody te opisano równaniami reakcji. Wskaż wśród nich procesy, które są reakcjami utlenienia‑redukcji. Odpowiedź uzasadnij.
a)
b)
c)
d)
e)
W naczyniu o pojemności wypełnionym chlorem (warunki normalne) umieszczono sodu. Ile gramów chlorku sodu powstało? Czy można się spodziewać, że w naczyniu pozostał jeszcze chlor?
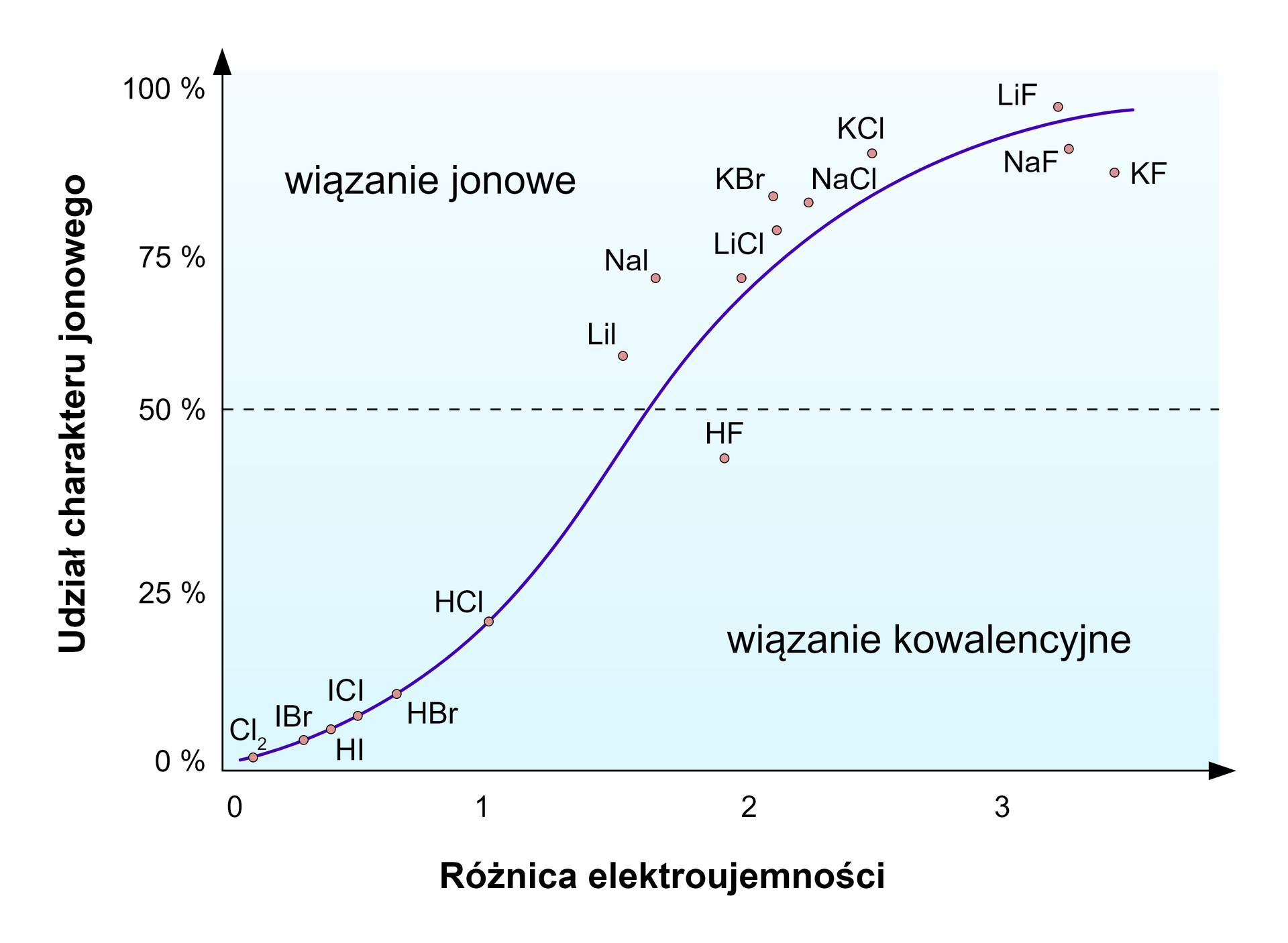
Zapoznaj się z wykresem przedstawiających udział wiązania jonowego w wybranych związkach fluorowców.
a) Wymień wszystkie podane na wykresie chlorki i bromki metali.
b) Uszereguj te związki od najmniejszego do największego udziału wiązania jonowego.
Na podstawie poniższego schematu sformułuj obserwacje i wnioski (zapisz odpowiednie równania reakcji) do doświadczenia „Spalanie metali w chlorze w układzie zamkniętym”.
Na podstawie opisu schematu sformułuj obserwacje i wnioski (zapisz odpowiednie równania reakcji) do doświadczenia „Spalanie metali w chlorze w układzie zamkniętym”.
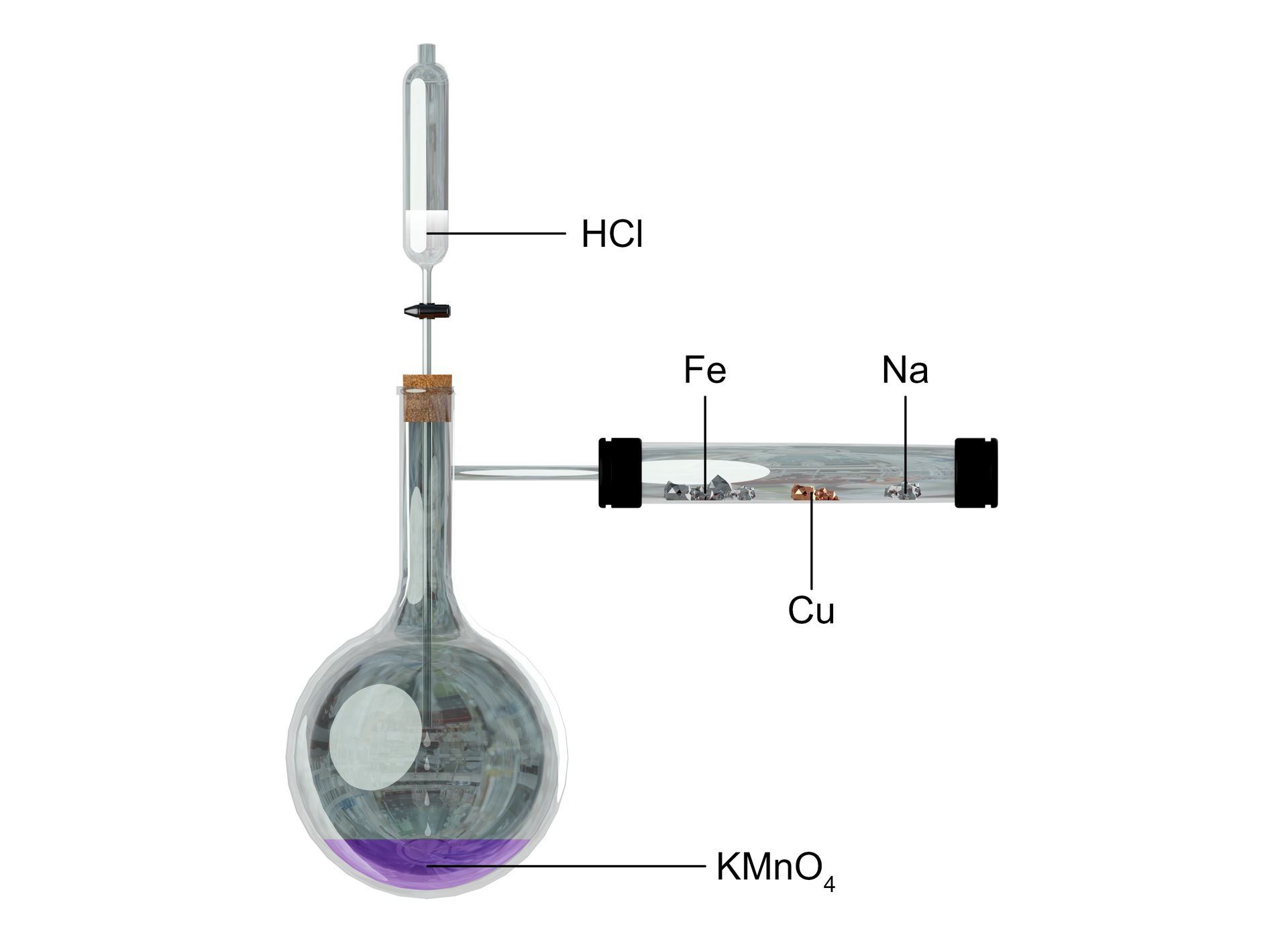
Indeks górny Źródło: Piosik R., Karawajczyk B., Technika demonstracji i ćwiczenia laboratoryjne z metodyki nauczania chemii i ochrony środowiska, Gdańsk 2004, s. 790‑81. Indeks górny koniecŹródło: Piosik R., Karawajczyk B., Technika demonstracji i ćwiczenia laboratoryjne z metodyki nauczania chemii i ochrony środowiska, Gdańsk 2004, s. 790‑81.