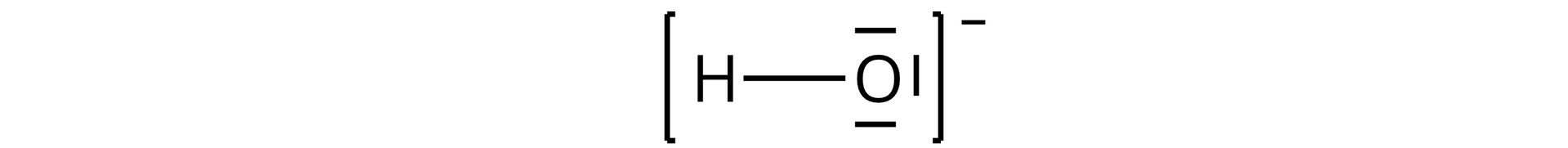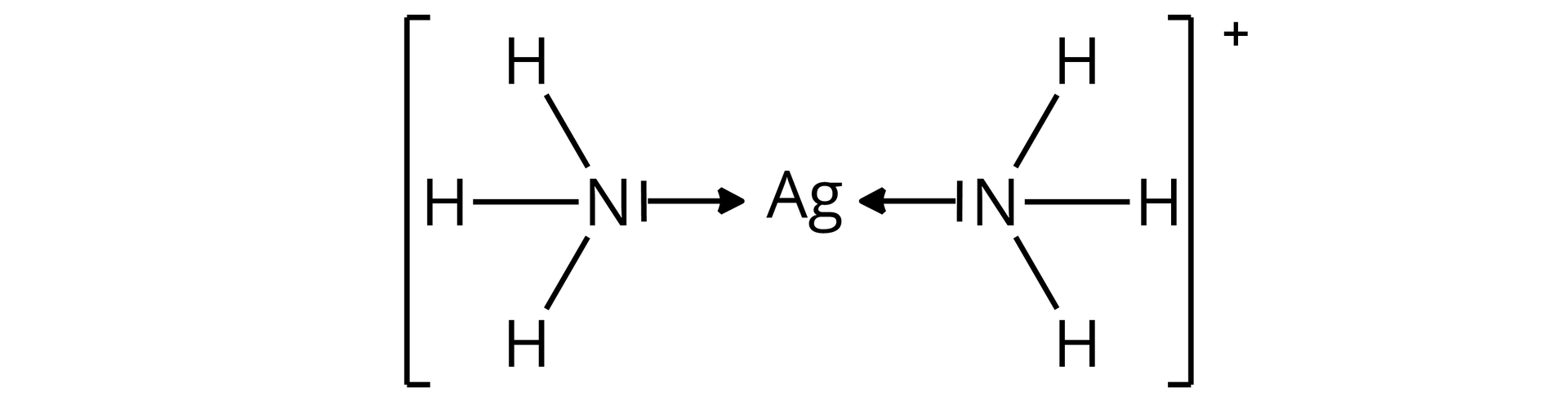Sprawdź się
Połącz w pary pojęcia z odpowiednimi definicjami.
rodzaj wiązania chemicznego, które polega na uwspólnieniu pary elektronowej tylko jednego atomu, tworzącego to wiązanie; występuje w związkach koordynacyjnych., związek koordynacyjny, w którym ligandami są cząsteczki wody., rodzaj oddziaływania międzycząsteczkowego lub wewnątrzcząsteczkowego, które występuje pomiędzy atomem wodoru a elektroujemnym pierwiastkiem, tj. tlenem, fluorem, azotem., dysocjacja elektrolityczna rozpuszczalnika amfiprotycznego, która zachodzi wskutek wymiany protonów między jego cząsteczkami.
| Wiązanie donorowo–akceptorowe | |
| Oddziaływanie wodorowe | |
| Autodysocjacja | |
| Akwakompleks |
Zaznacz poprawną odpowiedź.
Wiązanie donorowo-akceptorowe można nazwać także wiązaniem:
- koordynacyjnym.
- jonowym.
- kowalencyjnym.
Na podstawie wzorów elektronowych i , określ, który z nich może pełnić funkcję donora pary elektronowej. Odpowiedź uzasadnij.
Uzupełnij zdania, wpisując słowa z podanych poniżej.
akceptorem, donorem, akceptora, donora, kowalencyjnym, donora, jonowym, wodorowym, donorowo-akceptorowym, akceptorem
Wiązanie chemiczne, w którym wiążąca para elektronowa pochodzi od jednego atomu, nazywane jest wiązaniem ........................................... Atom, który jest dawcą pary elektronowej, nosi nazwę ........................................... Jego zadaniem jest związać się z .........................................., czyli atomem o niezapełnionej powłoce walencyjnej.
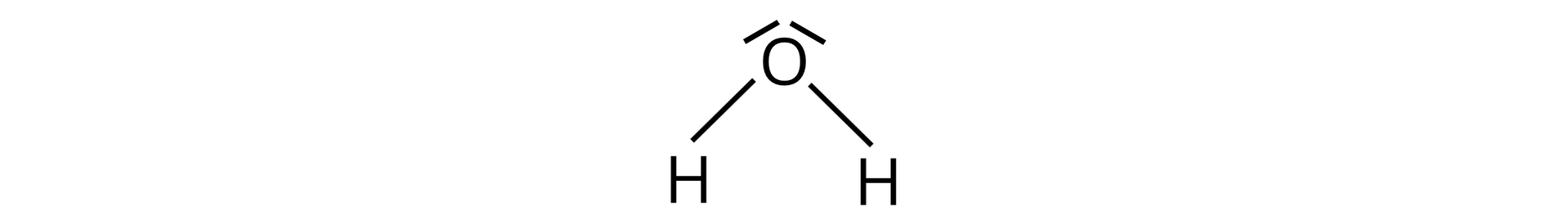
Woda ulega autodysocjacji, której przebieg można zapisać za pomocą poniższego równania reakcji:
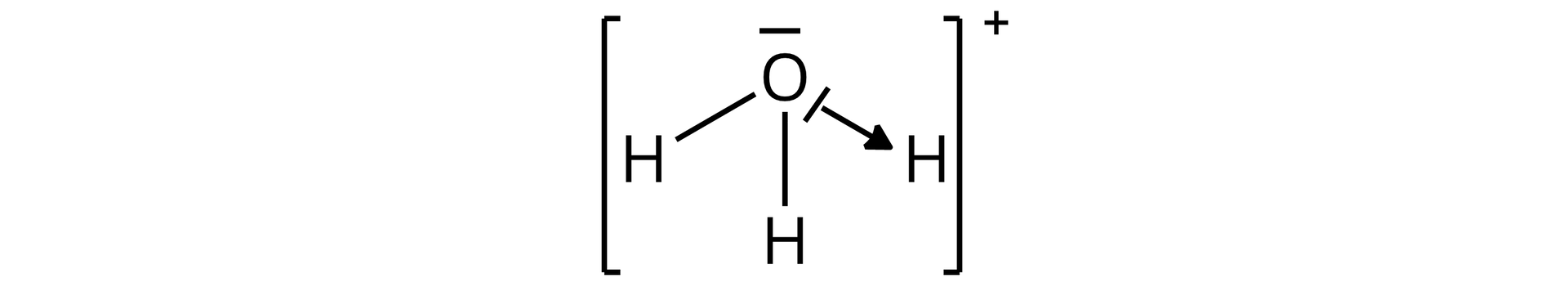
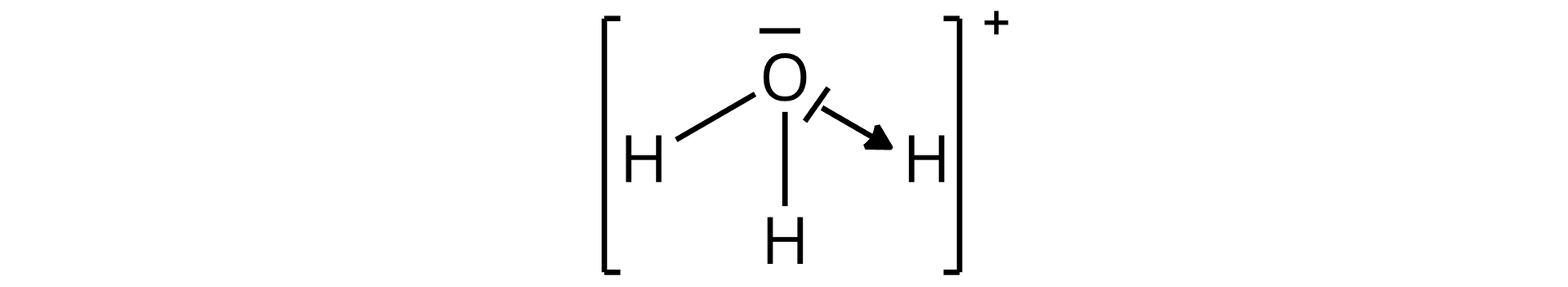
W jednym z indywiduów chemicznych, uczestniczących w procesie autodysocjacji wody, znajduje się wiązanie koordynacyjne. Podaj jego nazwę oraz narysuj wzór elektronowy (Lewisa) kreskowy.
W jednym z indywiduów chemicznych, uczestniczących w procesie autodysocjacji wody, znajduje się wiązanie koordynacyjne. Podaj jego nazwę oraz opisz wzór elektronowy (Lewisa).
Chlorek glinu jest kwasem Lewisa i wykorzystuje się go jako katalizator w reakcji Friedela–Craftsa. Związek ten przyjmuje postać dimerów, o wzorze przedstawionym poniżej, gdy występuje w postaci ciekłej i gazowej, dla temperatury poniżej .
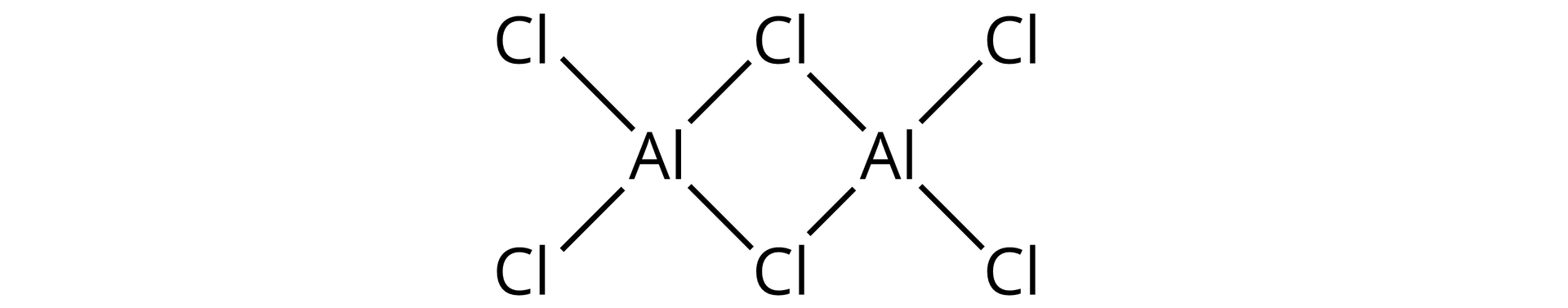
Określ, ile wiązań donorowo–akceptorowych występuje w cząsteczce dimeru chlorku glinu.
Napisz nazwę pierwiastka chemicznego, który pełni rolę akceptora par elektronowych w dimerze chlorku glinu – , przedstawionego za pomocą wzoru:
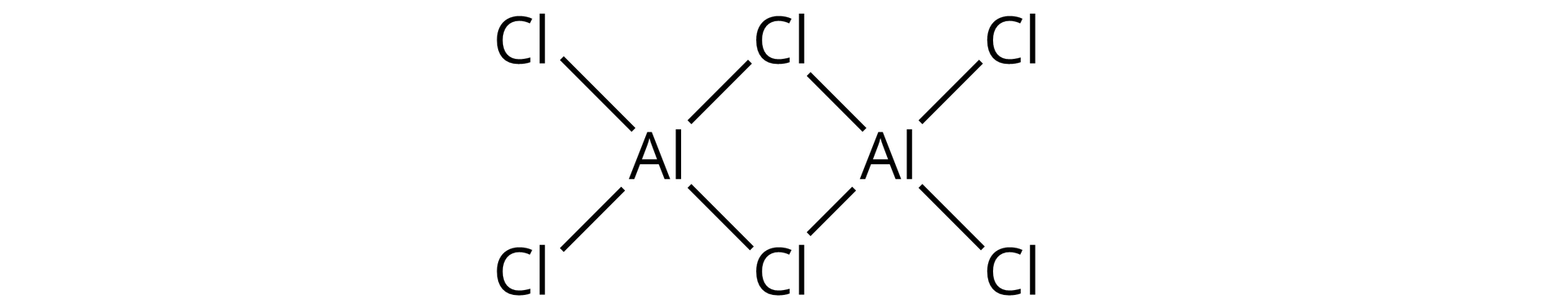
glin, chlor
Akceptor pary elektronowej: .............
Poniżej przedstawiono wzór kationu heksaakwamiedzi():
Zapoznaj się z opisem wzoru kationu heksaakwamiedzi():
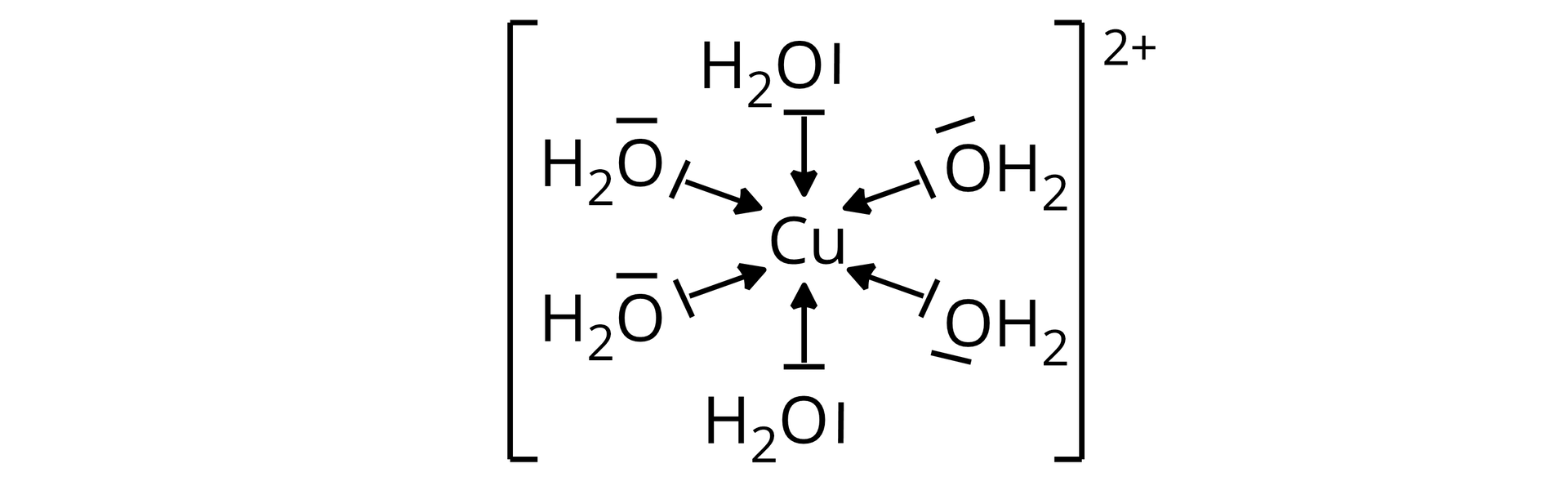
Podaj nazwę atomu, który:
tlen, wodór, miedź
Kation diaminasrebra() to jon o wzorze sumarycznym . Na podstawie wiedzy o związkach koordynacyjnych, zaproponuj jego wzór strukturalny.
Kation diaminasrebra() to jon o wzorze sumarycznym . Na podstawie wiedzy o związkach koordynacyjnych, zaproponuj jego wzór strukturalny i opisz słownie jego strukturę.
Hem to grupa prostetyczna, która występuje w hemoglobinie. W jej cząsteczce związany jest kation żelaza() lub kation żelaza() przez cztery wiązania azot–żelazo. Dwa z tych wiązań to wiązania kowalencyjne, a dwa pozostałe to wiązania koordynacyjne. Wzór elektronowy hemu przedstawiono poniżej:
Hem to grupa prostetyczna, która występuje w hemoglobinie. W jej cząsteczce związany jest kation żelaza() lub kation żelaza() przez cztery wiązania azot–żelazo. Dwa z tych wiązań to wiązania kowalencyjne, a dwa pozostałe to wiązania koordynacyjne. Zapoznaj się z opisem wzoru elektronowego hemu.
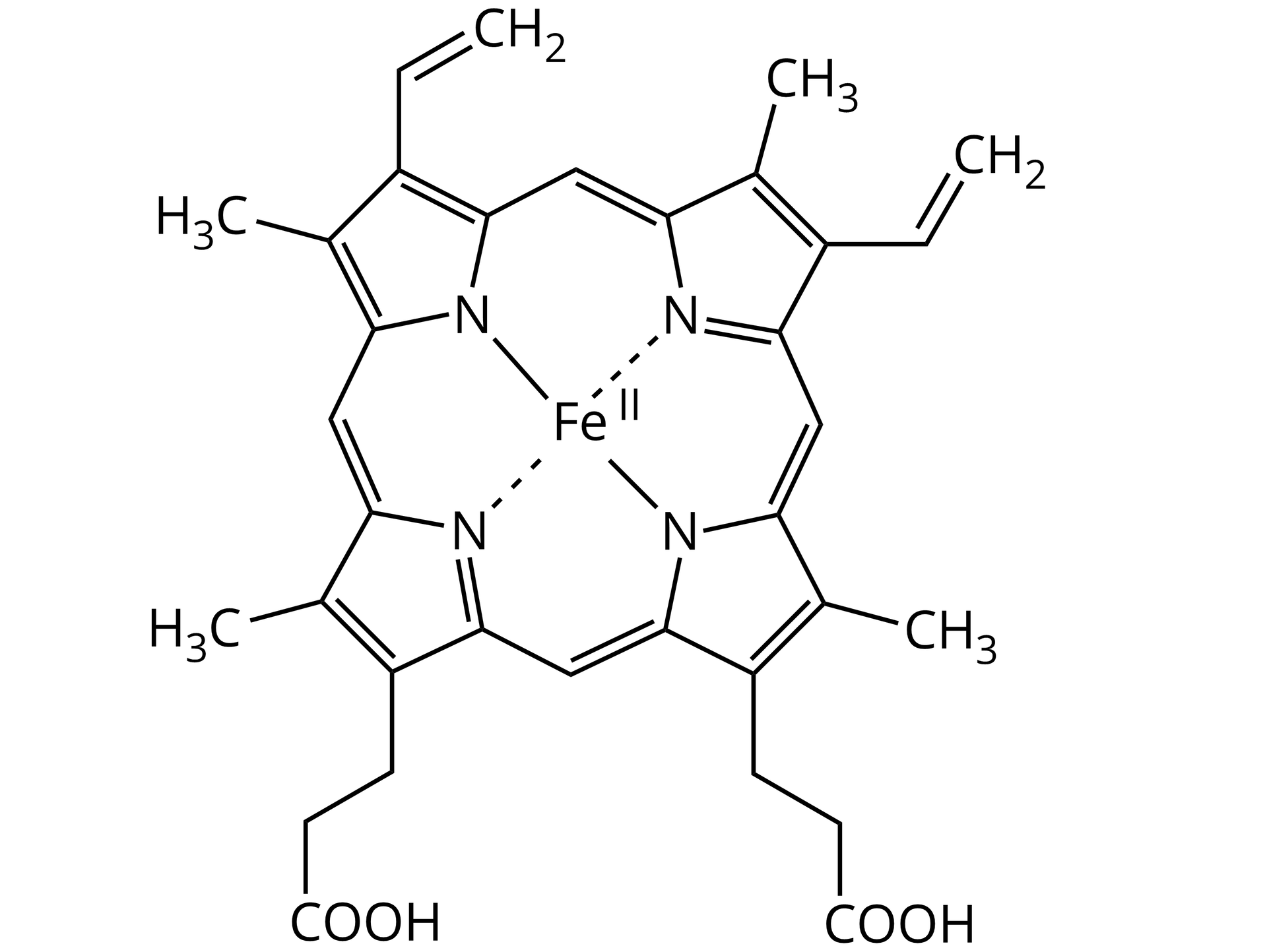
Podaj nazwę atomu, który:
pełni rolę donora pary elektronowej;
pełni rolę akceptora pary elektronowej.