Sprawdź się
Wybierz poprawne dokończenie poniższego zdania.
W wyniku autodysocjacji czystej wody w stanie równowagi (w temperaturze 25°C):
- stężenie jonów hydroniowych wynosi 55,5 .
- występuje jednakowa liczba jonów hydroniowych i jonów wodorotlenkowych.
- pH wody wynosi 4.
- występują wyłącznie jony OH-.
Podaj wyrażenie na iloczyn jonowy wody.
Skala pH jest ilościową skalą kwasowości i zasadowości roztworów wodnych opartą o stosunek jonów i , znajdujących się w tych roztworach. Zazwyczaj skalę pH przedstawia się w zakresie od 0 do 14:

Do szybkiej oceny pH stosuje się zazwyczaj papierki wskaźnikowe.

Zbadano pH pewnego roztworu wodnego przy pomocy papierka wskaźnikowego. Po porównaniu zabarwienia papierka ze skalą wykazano, że pH roztworu wynosiło 4. Oblicz pOH badanego roztworu oraz określ jego odczyn.
2. Roztwór ma odczyn obojętny przy pH 1. =, 2. <, 3. > 7.
3. Roztwór ma odczyn zasadowy, gdy pH 1. =, 2. <, 3. > 7.
Dopasuj zakres pH do odpowiedniego rodzaju odczynu.
<, >, =
1. Roztwór ma odczyn kwasowy, gdy pH ............ 7.
2. Roztwór ma odczyn obojętny przy pH ............ 7.
3. Roztwór ma odczyn zasadowy, gdy pH ............ 7.
Wykonano eksperyment, w którym zbadano zależność wartości iloczynu jonowego wody w zakresie temperatur 0°C - 100°C. Dane zgromadzono w tabeli.
Temp [°C] | 0 | 20 | 40 | 60 | 80 | 100 |
|---|---|---|---|---|---|---|
2. W temperaturze 0oC: Kw = [H3O+][OH-] = 1. nie zmienia się, 2. 3 ∙ 10-14, 3. 0,1 ∙ 10-14, 4. rośnie, 5. maleje, 6. 0,7 ∙ 10-14.
3. W temperaturze 40oC: Kw = [H3O+][OH-] = 1. nie zmienia się, 2. 3 ∙ 10-14, 3. 0,1 ∙ 10-14, 4. rośnie, 5. maleje, 6. 0,7 ∙ 10-14.
A. Oceń, jak zmienia się pH wody destylowanej (rośnie, maleje, nie zmienia się), jeśli próbkę wody o temperaturze 0°C podgrzejemy do 40°C.
maleje, 0,1 ∙ 10-14, 0,7 ∙ 10-14, 3 ∙ 10-14, nie zmienia się, rośnie
1. pH ................................, ponieważ rośnie stężenie jonów H3O+.
2. W temperaturze 0°C: Kw = [H3O+][OH-] = .................................
3. W temperaturze 40°C: Kw = [H3O+][OH-] = .................................
B. Oceń, czy w temperaturze 60°C roztwór o pH=7 jest obojętny. Odpowiedź uzasadnij.
Wykonano eksperyment, w którym zbadano zależność wartości iloczynu jonowego wody w zakresie temperatur 0°C - 100°C. Dane zgromadzono w tabeli.
Temp [°C] | 0 | 20 | 40 | 60 | 80 | 100 |
|---|---|---|---|---|---|---|
Oblicz stężenie jonów wodorotlenkowych pochodzących z autodysocjacji wody, gdy stężenie jonów hydroniowych w temperaturze 40°C wynosi .
Pod względem budowy woda i alkohol etylowy (etanol) są do siebie podobne.
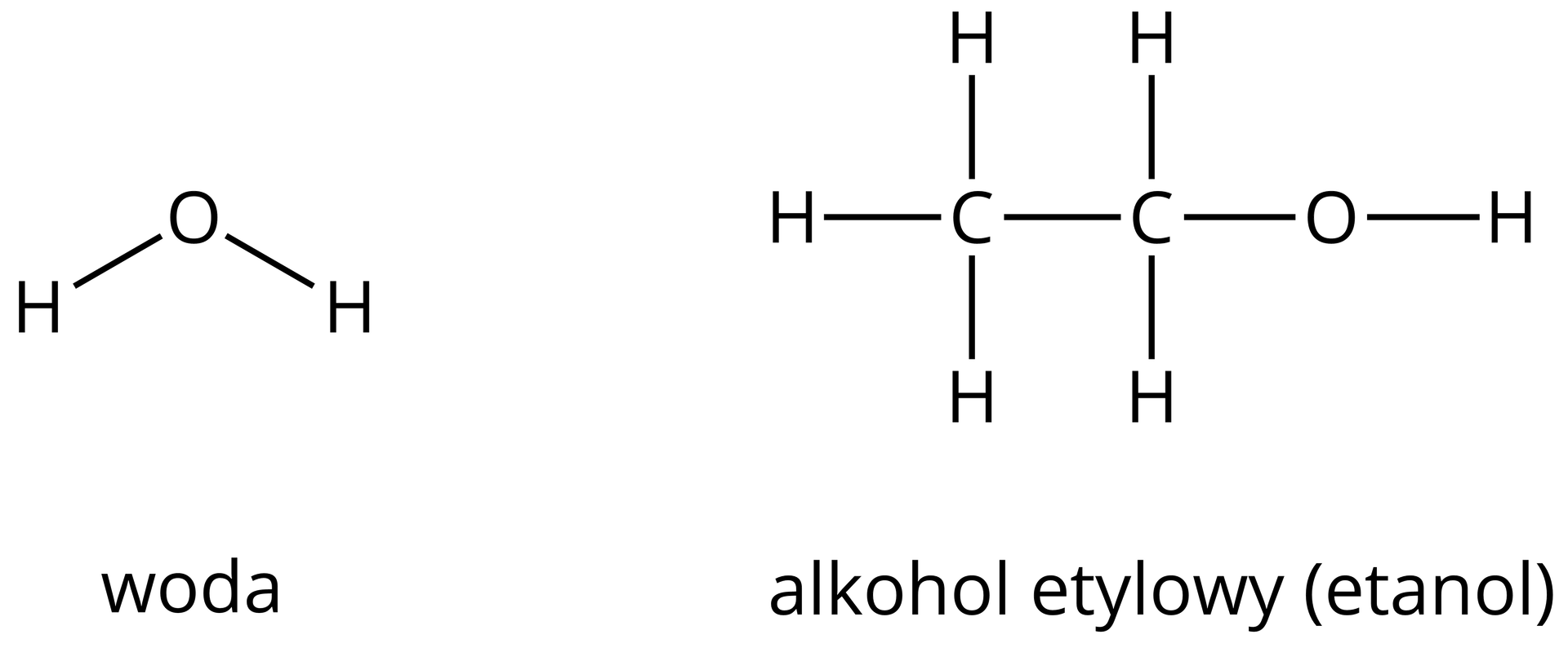
Zarówno cząsteczka wody jak i etanol są rozpuszczalnikami protonowymi, a więc są zdolne do autodysocjacji. Zgodnie z protonową teorią Brønsteda‑Lowry’ego proces autodysocjacji wygląda następująco.
W oparciu o teorię Brønsteda-Lowry’ego zapisz reakcję autodysocjacji etanolu.