Sprawdź się
Wskaż, która z poniższych jest jednostką szybkości reakcji chemicznej.
Wskaż poprawny wzór, definiujący szybkość reakcji chemicznej.
Wskaż poprawne odpowiedzi (kilka odpowiedzi jest poprawnych).
- Szybkość reakcji nie zmienia się w czasie, jest wielkością stałą.
- Szybkość reakcji zmienia się w czasie.
- Szybkość reakcji zmienia się w czasie (wzrasta w miarę upływu czasu).
- Szybkość reakcji chemicznej w niektórych przypadkach można wyznaczyć za pomocą pomiaru pH.
W trakcie reakcji chemicznej, przebiegającej według równania:
powstaje , którego stężenie zmienia się od do w przedziale czasu sekund. Oblicz średnią szybkość reakcji w podanym przedziale czasu.
W trakcie pewnej reakcji stężenie substratu zmienia się od do w czasie dwóch minut. Oblicz średnią szybkość reakcji w podanym przedziale czasu.
Przeprowadzono reakcję przebiegającą według równania:
Podczas przeprowadzania tej reakcji monitorowano ubytek substratu. Stężenie zmniejszyło się z do . Taką zmianę zauważono między a minutą reakcji. Oblicz średnią szybkość tej reakcji w tym przedziale czasowym.
W laboratorium chemicznym przeprowadzono reakcję, którą można zapisać równaniem:
W czasie trwania reakcji mierzono szybkość wydzielania się wodoru w jednostce czasu. Na podstawie danych zawartych w poniższej tabeli narysuj wykres zależności objętości wydzielonego wodoru od czasu i uzgodnij, jaka będzie szybkość takiej reakcji. Co możesz powiedzieć o szybkości tej reakcji, patrząc na sporządzony wykres?
W czasie trwania reakcji mierzono szybkość wydzielania się wodoru w jednostce czasu. Na podstawie danych zawartych w poniższej tabeli opisz zależność objętości wydzielonego wodoru od czasu. Podaj, jaka będzie szybkość takiej reakcji.
czas | Objętość |
|---|---|
5 | |
Mierzono stężenie powstałego w reakcji przebiegającej według równania:
Wyniki, które uzyskano, przedstawiono na poniższym wykresie.
Wyniki, które uzyskano, przedstawiono na wykresie. Zapoznaj się z jego opisem.
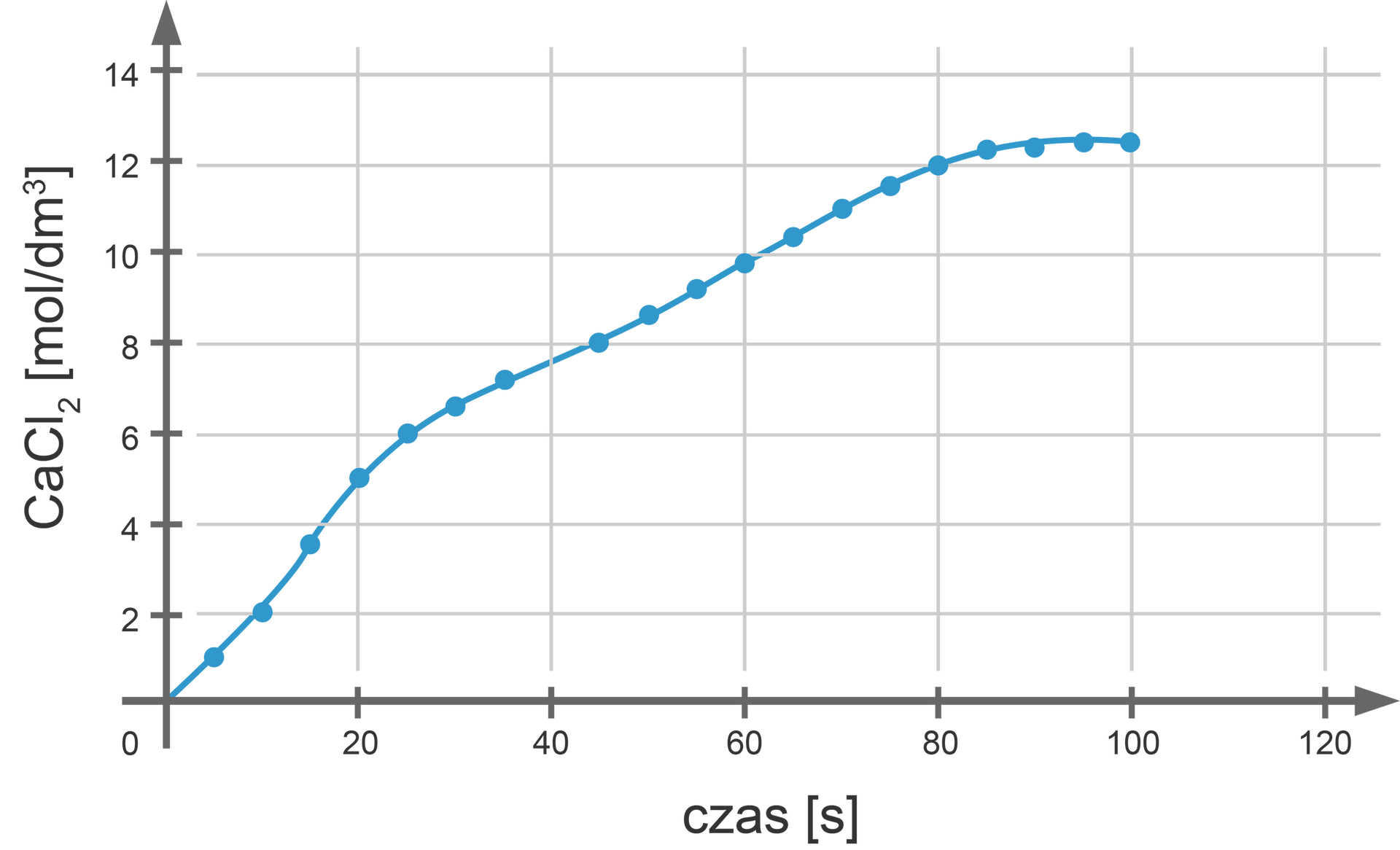
Oblicz średnią szybkość reakcji chemicznej:
a) w jej fazie początkowej (od początku jej trwania do sekundy);
b) w fazie środkowej (od do sekundy).