Sprawdź się
Aby stopić sól jonową, należy dostarczyć ogromną ilość 1. maleje, 2. amoniak, 3. azot, 4. cząsteczek, 5. energii, 6. kationów, 7. temperaturze topnienia, 8. temperatury, 9. absorbancji, 10. termicznej, 11. wody, 12. temperaturze zera bezwzględnego, 13. elektrolitycznej, 14. emituje, która umożliwi oddalenie się od siebie 1. maleje, 2. amoniak, 3. azot, 4. cząsteczek, 5. energii, 6. kationów, 7. temperaturze topnienia, 8. temperatury, 9. absorbancji, 10. termicznej, 11. wody, 12. temperaturze zera bezwzględnego, 13. elektrolitycznej, 14. emituje i anionów. W 1. maleje, 2. amoniak, 3. azot, 4. cząsteczek, 5. energii, 6. kationów, 7. temperaturze topnienia, 8. temperatury, 9. absorbancji, 10. termicznej, 11. wody, 12. temperaturze zera bezwzględnego, 13. elektrolitycznej, 14. emituje jony opuszczają swoje miejsca sieciowe, a siła ich wzajemnego oddziaływania 1. maleje, 2. amoniak, 3. azot, 4. cząsteczek, 5. energii, 6. kationów, 7. temperaturze topnienia, 8. temperatury, 9. absorbancji, 10. termicznej, 11. wody, 12. temperaturze zera bezwzględnego, 13. elektrolitycznej, 14. emituje.
Uzupełnij równania reakcji zachodzących podczas ogrzewania wodorowęglanu potasu oraz węglanu amonu.
Odpowiedz na pytanie, dlaczego temperatura topnienia soli kuchennej jest tak wysoka. Do rozwiązania tego zadania skorzystaj również z innych źródeł informacji.
Prażenie węglanu wapnia jest jedną z metod otrzymywania wapna palonego. Proces ten można zilustrować równaniem reakcji:
Oblicz, jaka objętość gazu (w , w przeliczeniu na warunki normalne) powstanie, jeżeli do reakcji zostanie użyte węglanu wapnia. Wynik podaj z dokładnością do dwóch miejsc po przecinku.
Przeprowadzono doświadczenie chemiczne zilustrowane poniższym rysunkiem, którego celem było zbadanie wpływu temperatury na zachowanie soli. W tym celu niewielką ilość przesypano na dno suchej probówki i ogrzewano przez trzy minuty. Jakich obserwacji powinien spodziewać się uczeń wykonujący doświadczenie? Odpowiedź uzasadnij, pisząc odpowiednie równania reakcji w formie cząsteczkowej.
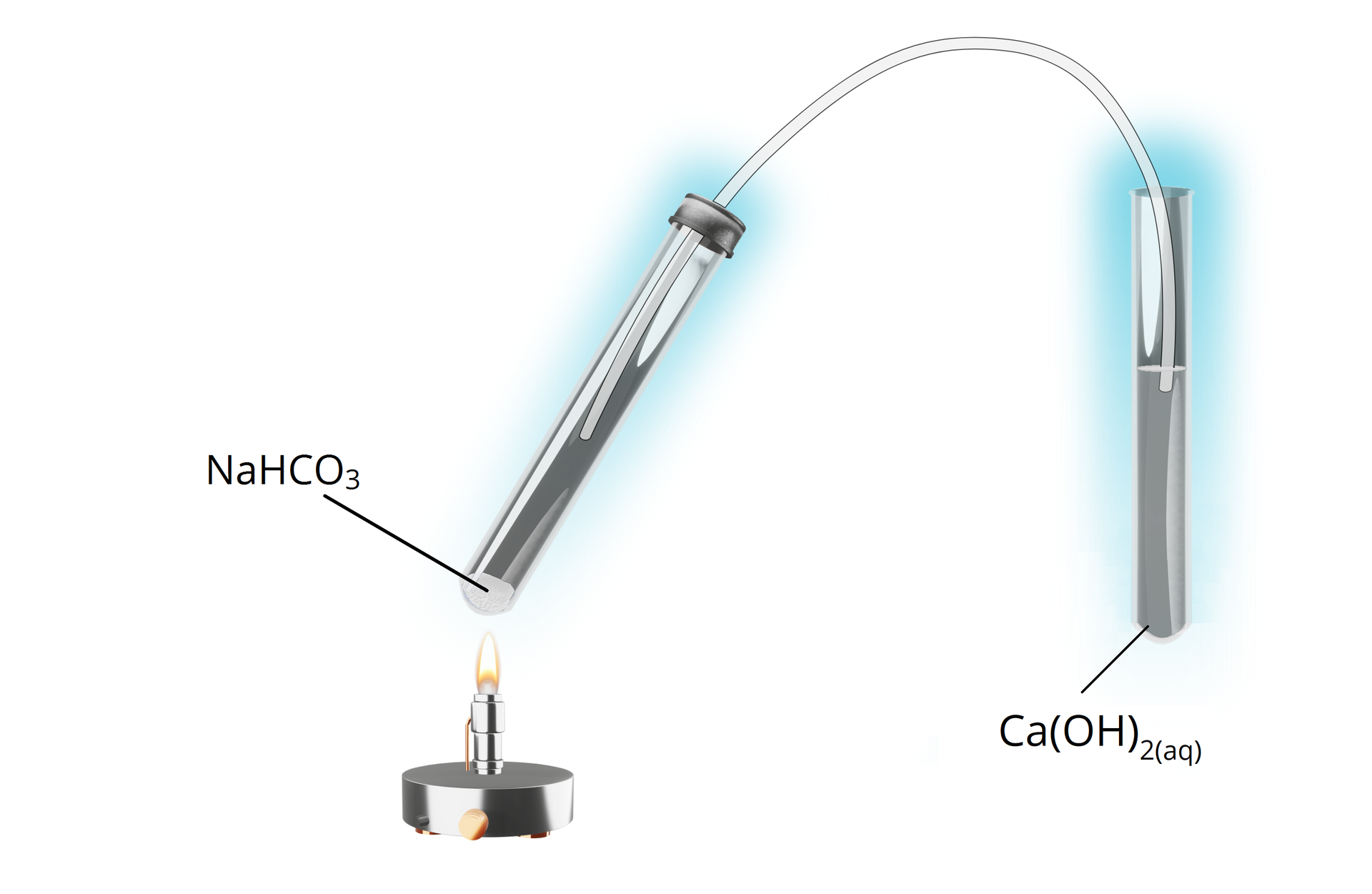
Przeprowadzono doświadczenie chemiczne, którego opis przedstawiono poniżej:
„W probówce umieszczono manganianu() potasu. Następnie zmontowano zestaw zgodnie z rysunkiem zamieszczonym poniżej. Probówka z manganianem() potasu została ogrzana w płomieniu palnika. Po zakończeniu reakcji, cylinder został wyjęty z krystalizatora, a jego wylot zamknięto korkiem. Cylinder został postawiony na stole, a po otwarciu korka wprowadzono do jego wnętrza tlące się łuczywko.”
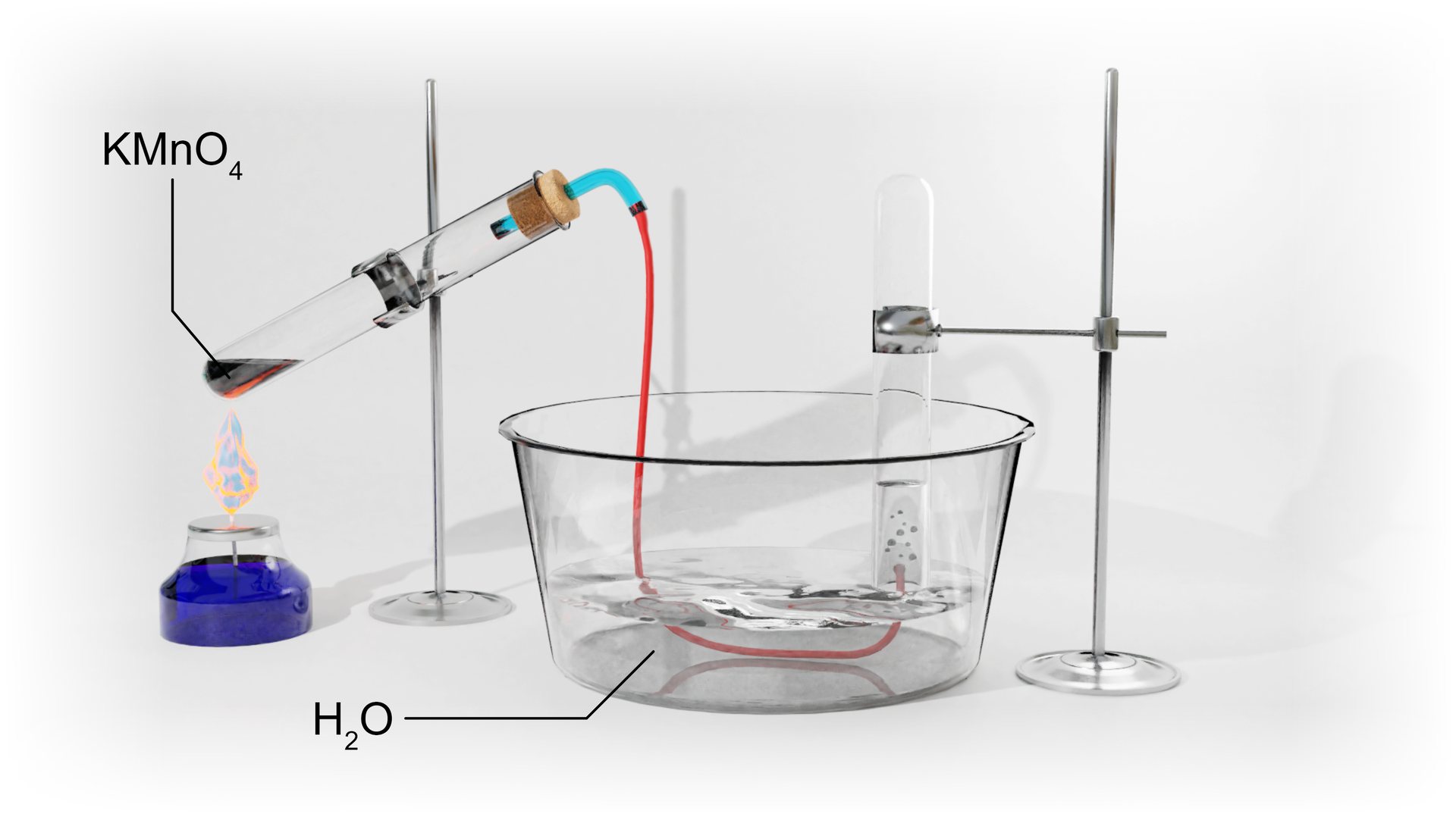
Zapisz obserwacje z przeprowadzonego doświadczenia oraz sformułuj wnioski uwzględniające równanie reakcji chemicznej zapisane w formie cząsteczkowej.